This is a SEO version of 110413CHI_BR_DF_JB_ID11494_FinalCut_ABC_send_15_WEBblaetter_kl. Click here to view full version
« Previous Page Table of Contents Next Page »192 Allgemein-, Viszeral- und Transplantationschirurgie
Wissenschaftliches Konzept
Aufgrund der langjährigen Mitarbeit in der trans-lationalen Onkologie besitzt I. Herr viel Erfahrung in der patientennahen Forschung. Laufende und geplante Projekte fokussieren auf die Analyse von Resistenzmechanismen bei Krebsstammzellen und deren nebenwirkungsarme Eliminierung.
Vor kurzem publizierte Projekte
Aktuelle Schwerpunkte konzentrieren sich auf adulte Stammzellen und deren Funktion bei Wachstum und Resistenz von Tumoren. Seit 2005 untersucht das Team um I. Herr die Rolle von me-senchymalen Stammzellen (MSC) aus dem Kno-chenmark für das Tumorwachstum des Pankre-askarzinoms. Dabei wurden Mechanismen der spezifischen Wanderung von MSC aus dem Kno-chenmark in das Pankreaskarzinom aufgeklär t und ein Beitrag der MSC zur Blutgefäßbildung des Pankreaskarzinoms gefunden. Etabliert in der Ar-beitsgruppe sind daher Methoden zur Gewinnung und Charakterisierung von MSC sowie zu deren genetischer Veränderung mittels lentiviralen Vek-toren. Ebenfalls etabliert sind subkutane und or-thotope Xenograftmodelle auf Nacktmäusen. Di-ese werden für die in vivo Charakterisierung von MSC benötigt. (Kallifatidis et al, Cancer Gene Ther 2008; Beckermann et al, Brit J Cancer 2008; Apel et al. Exp. Cell Res 2009).
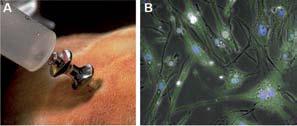
Gewinnung von MSC und lentivirale Transduktion.
A. Knochenmark wird mit einer Knochenstanze aus aus dem Beckenkamm entnommen.
B. Daraus werden MSC isoliert und mittels eines lentiviralen Vektors mit eGFP markiert.
Ein weiterer Schwerpunkt, den die Arbeitsgrup-pe seit 2007 untersucht, ist die Rolle von Krebs-stammzellen (KSZ) bei der Therapieresistenz gas-trointestinaler Tumore. Bereits publizierte Daten zeigen eine Beteiligung von NF- K B und defekter Apoptosesignalwege bei der Therapieresistenz
von KSZ des Pankreaskarzinoms (Kallifatidis et al., GUT 2009). Andere vor kurzem durchgeführte Projekte evaluieren Strategien für eine zielgerich-tete Eliminierung von KSZ durch EpCAMxCD3 bis-pezifische Antikörper (Salnikov et al., J Cell Mol Med 2009). Zwei weitere Publikationen beschäf-tigen sich mit der Detektion von KSZ im Tumor-gewebe von Patienten mit Lungen-, Darm- und Leberkrebs. Sie korrelieren die Expression von Markern für KSZ zu Prognose und klinischem Er-folg (Salnikov et al., Cancer Lett 2009; Salnikov et al., Int J Cancer 2009). Im Rahmen dieser Stu-dien hat die Arbeitsgruppe ein breites Wissen im Nachweis von KSZ-Markern und der Analyse von Stammzellmechanismen erworben.
Laufende, aktuelle Projekte
Gen-Immuntherapie beim fortgeschrittenen Pan-kreas- und Prostatakarzinom
Kooperation mit Dr. G. Moldenhauer, DKFZ Heidel-berg
Wir haben während der letzten Jahre die Instru-mente und Voraussetzungen für eine zielgerich-tete Gen-Immuntherapie geschaffen, mit der Tu-moren und deren Metastasen abgetötet werden können. Der Todesligand Tumour necrosis factor (TNF)-related apoptosis inducing ligand (TRAIL/ Apo2L) wird als therapeutisches Gen verwendet, weil dessen Proteinprodukt selektiv entartete Zel-len, nicht aber normale Körperzellen in den pro-grammierten Zelltod treibt. Um mithilfe von TRAIL die zytotoxische Wirkung von autologen T Zellen (CTLs) von Patienten zu verstärken, über tragen wir ex vivo das TRAIL-Gen unter der Kontrolle eines Tetrazyklin-induzierbaren Promotors mit Hilfe der lentiviralen Vektortechnologie. Da wir ein Resistenzgen in die lentiviralen Vektoren kloniert haben, erhalten wir innerhalb weniger Tage eine 100% transduzierte CTL-Population. Bispezifische Antikörper (BIABs) sollen eingesetzt werden, die mit einem Arm an die CTLs gekoppelt sind und mit dem anderen Arm die Tumorzelle binden. Di-ese Antikörper wurden bereits mit großem Erfolg von unserem Kooperationspartner am DKFZ, Dr. Gerhard Moldenhauer, in der Klinik eingesetzt und konnten die Aszitesbildung beim Ovarialkar-zinom deutlich reduzieren. Da die CTLs im Körper durch den tumorspezif ischen Arm des Antikör-pers besser an die Tumorzellen binden, können
This is a SEO version of 110413CHI_BR_DF_JB_ID11494_FinalCut_ABC_send_15_WEBblaetter_kl. Click here to view full version
« Previous Page Table of Contents Next Page »