Sektionsleiter
Prof. Dr. med. Ronald Koschny
Schwerpunkt
interventionelle Endoskopie, experimentelle Endoskopie, Polyposis-Syndrome
Die Welt der medizinischen Forschung ist ständig in Bewegung und innovative Technologien revolutionieren auch in der Endoskopie Diagnostik und Therapie. Damit der Patient von heute nicht allzu lang auf die Technik von morgen zu warten braucht, bildet unsere Sektion die aktuelle Schnittstelle zwischen endoskopischer Forschung und Praxis. Wir wollen Fortschritte in der Endoskopie schneller und effektiver für die Patientenversorgung nutzbar machen - von präziseren Diagnosemethoden bis hin zu minimalinvasiven Therapien. Die translationale Forschung verbindet außerdem wissenschaftliche Erkenntnisse aus der Grundlagenforschung mit der technologischen Entwicklung und ihrer Anwendung in der klinischen Praxis. Dazu fördern wir den Austausch von Wissen, Technologien und Best Practices zwischen Forschern, Klinikern, Endoskopikern und Industriepartnern.
Unsere Schwerpunkte
- Innovationen vorantreiben:
Entwicklung neuer endoskopischer Technologien und Methoden. - Wissenschaft vernetzen:
Förderung der Zusammenarbeit zwischen Forschungszentren, Universitäten und Endoskopiezentren. - Praxisnah forschen:
Direkte Anwendung der Forschungsergebnisse, um die Patientenversorgung zu verbessern. - Bildung und Training:
Organisation von Workshops, Konferenzen und Schulungsprogrammen für Fachkräfte.
Lernen Sie uns kennen!
Ob Sie Forscher, Arzt, Ingenieur oder Patient sind – Ihre Perspektive zählt. Gemeinsam können wir die Zukunft der Endoskopie gestalten. Entdecken Sie unsere Projekte, nehmen Sie an unseren Veranstaltungen teil oder unterstützen Sie unsere Ziele durch eine Partnerschaft. Besuchen Sie uns regelmäßig für aktuelle Informationen und Entwicklungen in der translationalen Endoskopie-Forschung.
Spannende Fälle aus der Endoskopie können Sie auch in unserer Rubrik Bild des Monats sehen. Finden Sie die richtige Diagnose zu diesem und vielen anderen endoskopischen Bildern heraus:
Endoskopische Forschung
Künstliche Intelligenz zur Bestimmung der Adenomlast im Duodenum und Erkennung von Magenadenomen bei FAP-Patienten
Fast alle FAP-Patienten entwickeln im Laufe ihres Lebens Adenome im Duodenum, die in Abhängigkeit von der Adenomzahl, -größe und -histologie auch zu einem Duodenalkarzinom entarten können. Eine grobe Abschätzung des Risikos erfolgt über die Spigelman-Klassifikation. Allerdings ist es zum einem gar nicht so einfach, die Zahl und Größe von Adenomen im Duodenum zu schätzen. Zum anderen werden größere Adenome mittlerweile endoskopisch abgetragen, sodass die Momentaufnahme im Duodenum vielleicht nicht dem zugrunde liegenden Gesamtrisiko entspricht. Dies wäre vielleicht mit der kumulativen Adenomlast, also unter Berücksichtigt der bereits abgetragenen Adenomflächen, besser vorhersagbar.
Ein zweites Problem besteht in der Erkennung von Adenomen im Magen bei FAP-Patienten, was durch die oft flächig ausgedehnten Drüsenkörperzysten erschwert ist. Dennoch deuten neuere Daten auf ein erhöhtes Magenkarzinomrisiko bei FAP-Patienten hin, was oft selbst unter endoskopischer Überwachung entsteht. Darum hat die Früherkennung von Magenadenomen zu deren endoskopischen Abtragung und von Frühkarzinomen zu kurativen Operation eine besondere Bedeutung.
Gemeinsam mit Prof. Dr. Alexander Hann und seiner Arbeitsgruppe Digitale Transformation in der Gastroenterologie arbeiten wir an einer Methode, mithilfe der künstlichen Intelligenz sowohl die Adenomlast im Duodenum als auch die Adenom-Erkennung im Magen von FAP-Patienten zu verbessern. Dieses Projekt wird unterstützt durch die Deutsche Krebshilfe.
Molekulare Forschung
Progression and Transformation of Early Colorectal Cancer and Therapy (PROTECT)
In Kooperation mit den Arbeitsgruppen von Dr. Jens Puschhof und Dr. Rene-Filip Jackstadt im DKFZ Heidelberg und dem Heidelberg Institute for Stem Cell Technology and Experimental Medicine (HI-STEM) arbeiten wir an der Entschlüsselung von Mechanismen der Entartung von gesunder Magen-Darm-Schleimhaut und von gutartigen Adenomen zu Karzinomen des Gastrointestinaltraktes bei Patienten mit einer Familiären Adenomatösen Polyposis (FAP). Diese Patienten, die wir klinisch in unserer Polyposis-Sprechstunde (Leiter Prof. Dr. R. Koschny) und endoskopisch im Interdisziplinären Endoskopiezentrum betreuen, können über unsere Registerstudie zur Polyposis an diesem Forschungsprojekt teilnehmen. Inwieweit hierbei das Mikrobiom eine Rolle spielt, wird in der Arbeitsgruppe von Dr. Puschhof untersucht, während das Labor von Dr. Jackstadt an molekularen Signalwegen und der Heterogenität Tumorzellen interessiert ist. Hierzu werden Gewebeproben der normalen Schleimhaut sowie von Adenomen und Karzinomen in gewebeartigen Organoiden angezüchtet, um die Interaktionen der verschiedenen Zellarten im Gewebe zu berücksichtigen.
Individuelle Endoskopische Lösungen
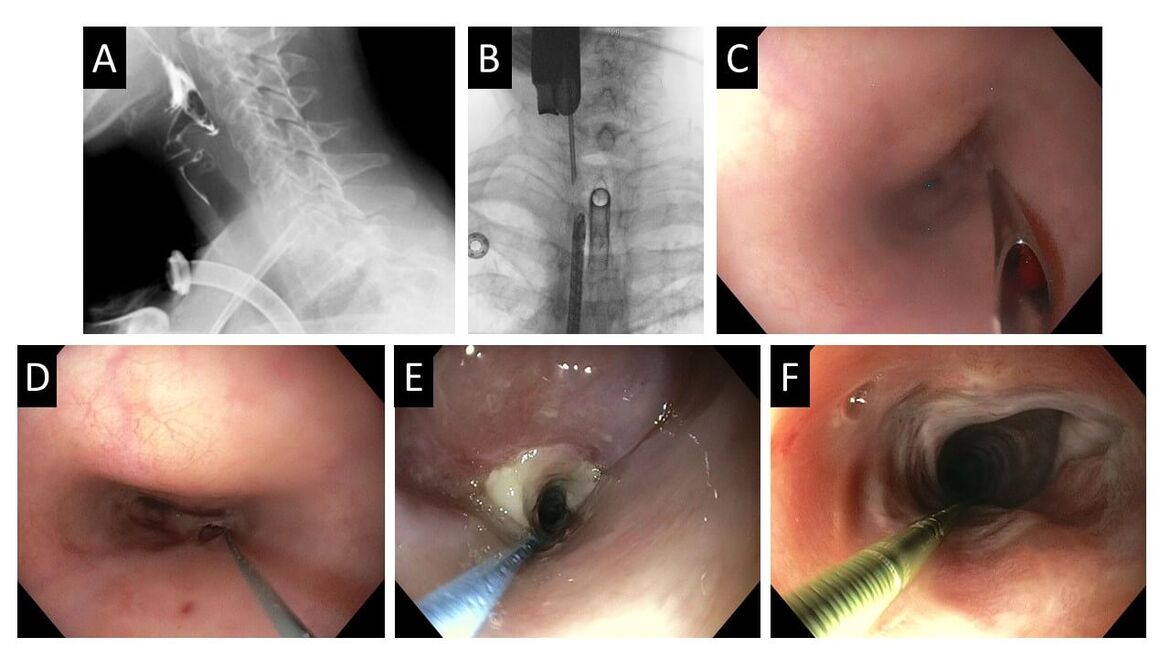
Endoskopische Wiedereröffnung eines obliterierten Ösophagus
Viele Patienten erleiden nach einer Radiochemotherapie des oberen Ösophagus eine Verengung durch Narbenbildung, einige sogar einen kompletten Verschluss der Speiseröhre (Obliteration). Operationen in dem bestrahlten Gebiet sind schwierig. Wir konnten einigen dieser Patienten durch ein Rendezvous-Verfahren helfen, bei dem Endoskopie und HNO unter großem Engagement von Prof. Dr. Dyckhoff zusammenarbeiteten.
Im Röntgen war erkennbar, das die Patienten Kontrastmittel nicht schlucken konnten (A) und dieses oft stattdessen in die Trachea überlief. Endoskopisch wurde von oralseitig ein kompletter Verschluss des Speiseröhreneingangs bestätigt. Alle Patienten wurden über eine PEG ernährt, sodass wir von unten nach Aufdehnung des PEG-Kanals mit einem dünnen Endoskop in den Magen vorspiegeln konnten und von hier nach oben in die Speiseröhre bis zum anderen Ende des Blindverschlusses. Unter Röntgenkontrolle wurde vom oberen blinden Ende mit einer Punktionsnadel das Narbengewebe durchstochen (B) und der Anschluss an die Speiseröhre wiederhergestellt (C). Durch die Kanüle wurde ein Draht in den unteren Ösophagus eingelegt (D), mit dem Endoskop von unten fixiert und der enge Kanal komplett eröffnet und erweitert. In den anschließenden Wochen erfolgten teilweise zahlreiche drahtgeführte Aufdehnungen der Rekanalisierung (E) bis die Patienten ein ausreichend großen Durchmesser erreichten, über den sie wieder schlucken konnten. Allerdings waren manchmal zahlreiche Dilatationen erforderlich und nicht immer konnte ein dauerhafter Erfolg erzielt werden. Besonders erfolgreich war die Methode bei eine kurzen wiederzueröffnenden Strecke und guter Mitarbeit des Patienten mit einem Schlucktraining. Unsere Ergebnisse der ersten 7 Patienten haben wir im Jahr 2024 veröffentlich.
Endoskopische Lösung für das Afferent Loop Syndrom
Das afferent loop Syndrom tritt nach Billroth II oder Roux-en-Y Operationen auf, wenn der zuführende (afferente) Dünndarmschenkel aufgrund einer Obstruktion dilatiert ist. Im onkologischen Setting geschieht dies zum Beispiel durch ein Tumorrezidiv.
Die endosonographisch geführte Anlage eines Lumen-apposing Metal Stents (LAMS) vom Restmagen aus in den gestauten Dünndarmschenkel (afferent loop) ist eine minimalinvasive Therapieoption für das Afferent-Loop-Syndrom. Sie bietet mehrere Vorteile gegenüber chirurgischen oder anderen interventionellen Verfahren:
- Minimalinvasiver Zugang: da kein großer chirurgischer Eingriff notwendig ist, ist die Morbidität niedriger, die Erholungszeit geringer
- Der Stent schafft eine schnelle direkte Drainageverbindung zwischen dem Restmagen und dem dilatierten afferenten Schenkel und reduziert sofort die Stase von Galle und Pankreassekret
- Dadurch kommt es zur raschen Besserung von postprandialen Schmerzen, Übelkeit und Erbrechen
- Im Vergleich zu chirurgischen Revisionen bleibt die ursprüngliche Magen-Darm-Passage erhalten
- Falls notwendig, kann der Stent endoskopisch entfernt oder gewechselt werden
- Besonders vorteilhaft ist die endoskopische Prozedur für Patienten, die für eine erneute Operation zu schwach sind
Die LAMS-Anlage ist somit eine moderne, patientenschonende Alternative zur chirurgischen Revision beim Afferent-Loop-Syndrom, insbesondere wenn eine chirurgische Therapie mit hohem Risiko verbunden wäre (Wu et al. 2023 Gut and Liver 17(3):351, Benallal et al. 2018 Endosc Ultrasound 7:418).
Im aufgezeigten Beispiel erlitt ein Patient nach Whipple-Operation bei einem Pankreaskopfkarzinom ein inoperables Lokalrezidiv mit Infiltration des abführenden Jejunalschenkels, der massiv dilatiert war und dem Patienten erhebliche Schmerzen bereiteten. Im EUS (A) und im CT (C) ist der dilatierte Schenkel deutlich erkennbar. Vom Restmagen aus konnte der dilatierte Schenke im EUS gut dargestellt werden und analog zum Vorgehen bei der EUS-Gastroenterostomie ein LAMS als Kurschlussverbindung zwischen gestautem Dünndarmschenkel und Restmagen platziert werden. Dies führte zur sofortigen Entspannung des Aufstaus und Beschwerdefreiheit direkt nach dem Eingriff. Im CT ist am Folgetag bereits der kollabierte afferente Schenkel mit einliegendem LAMS gut erkennbar.
Endoskopisch Technische Studien
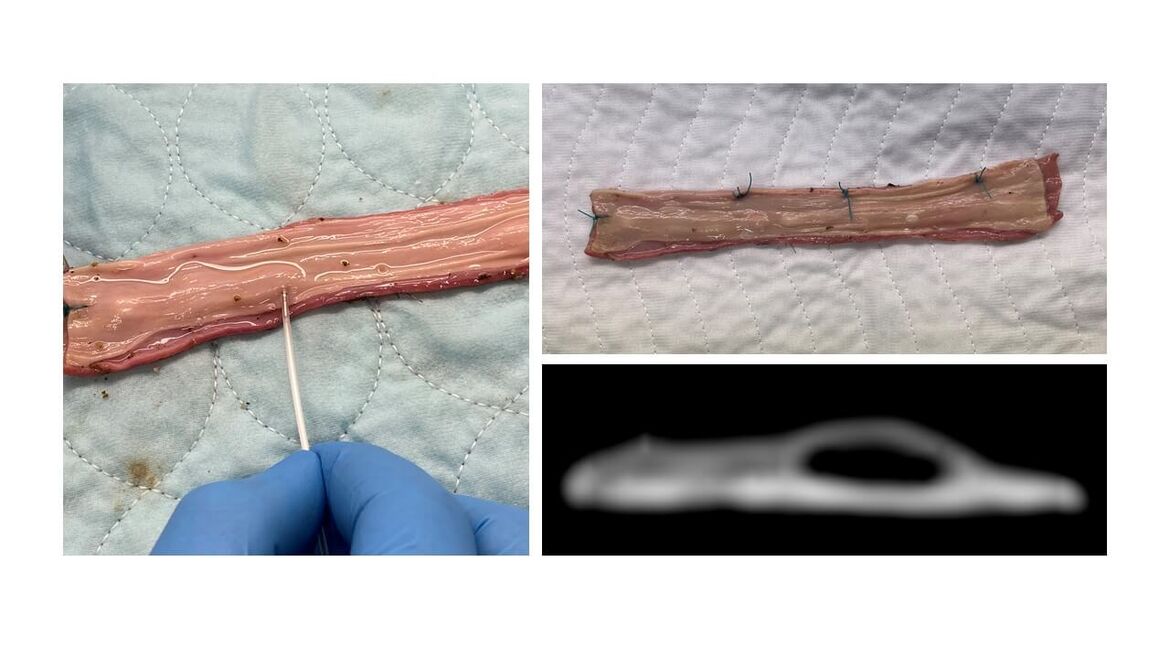
Optimierung einer Ösophagus-Markierung am Schweinemodell
Für eine Bestrahlung von Tumoren der Speiseröhre erfolgt die Planung des Strahlenfeldes bislang nach endoskopischer Clip-Markierung. Die Metallclips fallen jedoch schon innerhalb weniger Tage ab, was einen raschen CT-Termin erfordert, Nachjustierungen unmöglich macht und darum ein relativ großes Strahlenfeld mit breiten Sicherheitsrändern erfordert. Im Rahmen der PEGASUS-Studie optimiert die Radioonkologie der Uniklinik Heidelberg das Strahlenfeld nach endoskopischer Platzierung der Markierung in der Ösophagusschleimhaut.
Die Optimierung der endoskopischen Platzierung erfolgte in Zusammenarbeit mit Dr. Christoph Grott (Radiologische Klinik) am Schweine-Ösophagus mit anschließender Bildgebung im MRT.
Hierzu wurden in einen präparierten Ösophagus unterschiedlichen Mengen des Markers in verschiedenen Flüssigkeitskissen injiziert, um im anschließenden MRT einen optimalen Signalkontrast zu erreichen.
Moderne Endoskopische Techniken
In den letzten Jahren wurden zahlreiche endoskopische Verfahren als minimalinvasive Alternativen zur Operation entwickelt. Obwohl diese Techniken teilweise schon breite Anwendung im klinischen Alltag finden, müssen viele Details noch erforscht werden. Mit unserem Schwerpunkt auf der interventionellen Endoskopie setzen wir diese modernen Methoden in der täglichen Routine ein und arbeiten parallel an einer wissenschaftlichen Auswertung und Optimierung dieser Techniken. Sehen Sie sich gern unser endoskopisches Repertoir an:
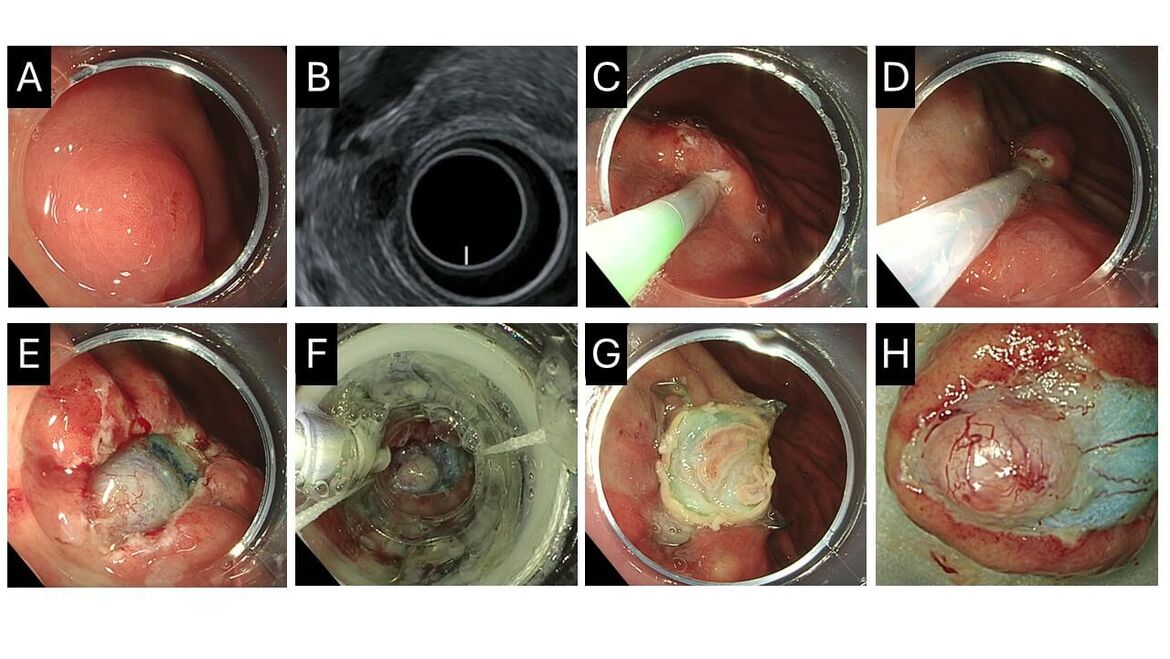
Endoskopische Vollwandresektion des Magens
Die endoskopische Vollwandresektion des Magens ist eine interessante minimal-invasive Alternative gegenüber der Operation zur Entfernung kleiner Prozesse der Magenwand. Auch wenn die Entfernung von bis zu 3cm großen Läsionen berichtet wurde, kann dies schon bei 2cm großen subepithelialen Tumoren schwierig werden, da die dicke Magenwand ein komplettes Einziehen in die FTRD-Kappe verhindern kann.
Wir verwenden in diesen Situationen eine Kombination aus einer Entdeckelung des Prozesses und der Vollwandresektion, was im Folgenden am Beispiel eines Patienten mit einer ca. 8mm großen Läsion der Muscularis propria (A, B) gezeigt werden soll, welche der Patient anstelle regelmäßiger Kontrollen endoskopisch abgetragen haben wollte.
Nach Unterspritzen der Submukosa (C) erfolgte die Abtragung der darüberliegenden Mukosa (D), was die subepitheliale Läsion freilegte (E) und leichter in den FTRD-Aufsatz einsaugen lies (F). Bei gutem Verschluss der Resektionsfläche (G) zeigte das Resektat eines komplett entfernten kleinen GISTs (H).
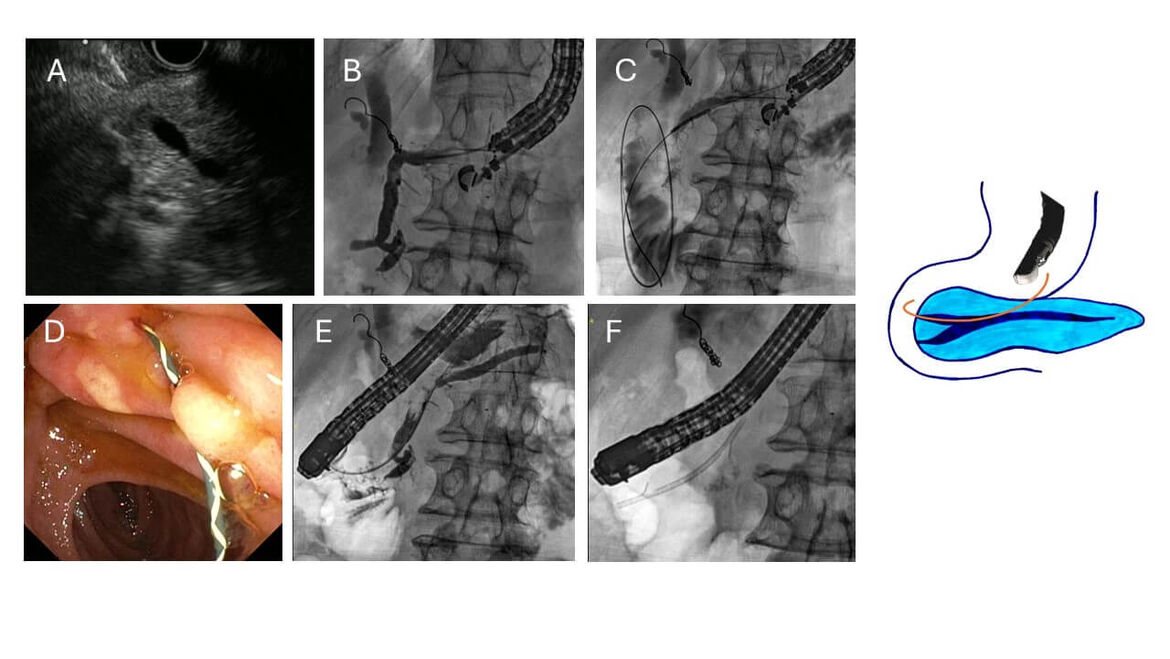
Internes Rendezvous zur Sondierung des Pankreasgangs
Es gibt Situationen, in denen eine notwendige Sondierung des Pankreasganges über die Papille im Rahmen einer ERCP nicht gelingt. Hier bietet die Endosonographie eine hilfreiche Ergänzung.
Im Fall eines Patienten mit rezidivierender Pankreatitis bei inkomplettem Pancreas divisum fand sich ein gestauter Pankreashauptgang, in diesem Fall dem Sonorini entsprechend. Bei der ERCP konnten weder die Major- noch die Minorpapille sondiert werden. Es erfolgte ein Wechsel auf den EUS-Sektorscanner und eine Darstellung des erweiterten Pankreasganges vom Magen aus (A). Der Gang konnte mit einer 9G EUS-Nadel punktiert und mit Kontrastmittel dargestellt werden (B). Über den Draht wurde die Magenwand mit einem Ringmesser passiert und der Draht über die Minorpapille ins Duodenum vorgeschoben werden (D). Nun wurde auf das Duodenoskop zurück gewechselt, der Draht im Lumen gefaßt und über den Arbeitskanal ausgeleitet. Hierüber konnte nun eine limitierte Papillotomie der Minorpapille erfolgen und eine 7F Endoprothese für 6 Monate eingelegt werden. In dieser Zeit und während der Nachbeobachtung traten keine weiteren Pankreatitisepisoden auf.
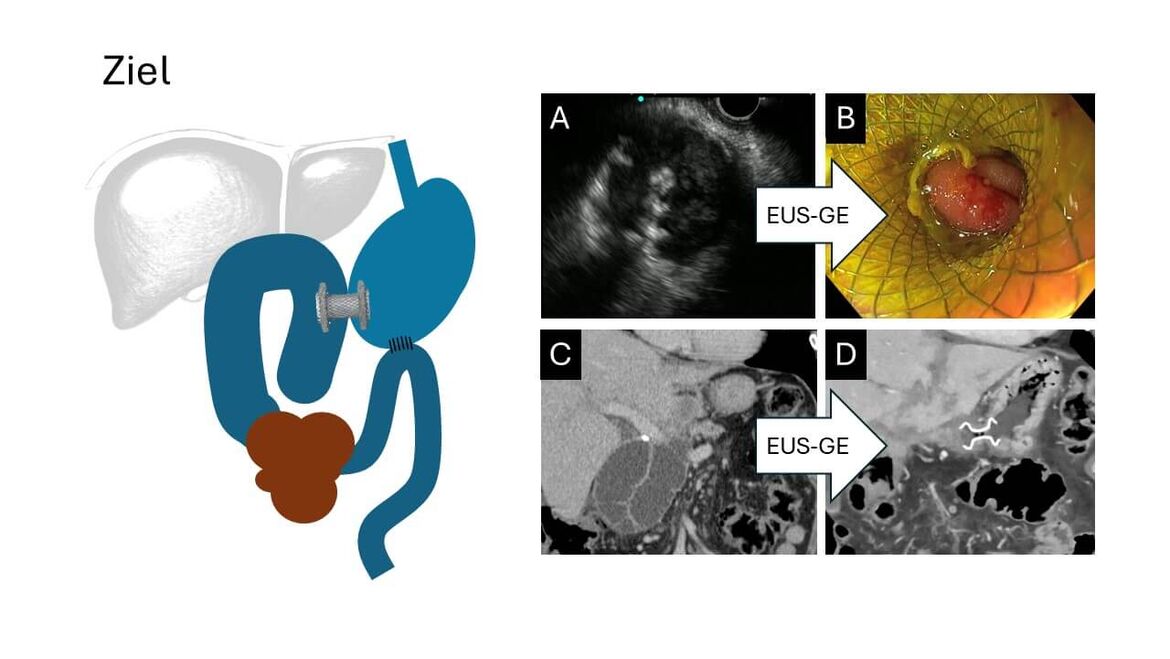
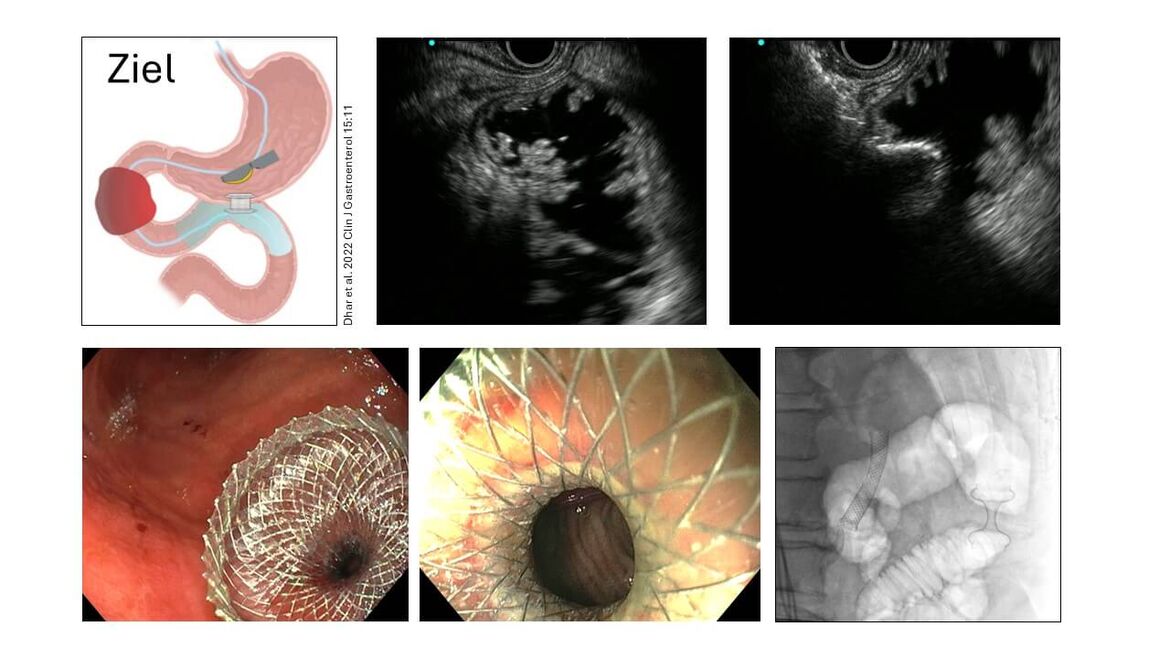
Endosonographisch gesteuerte Gastroenterostomie
Maligne Magenausgangsstenosen z.B. beim inoperablen Pankreaskopfkarzinom, dem metastasierten Duodenal- oder Magenkarzinom im Antrum oder eine Peritonealkarzinose beim Ovarialkarzinom führen bei den Patienten oft zu rezidivierendem Erbrechen mit Notwendigkeit einer Magensondenanlage und eingeschränkter Lebensqualität. Die Überbrückung der Engstelle im Magenausgang oder Duodenum mit einem selbstexpandierendem Metallstent (SEMS) führt zwar zu einer raschen Symptomlinderung bei hoher technischer Erfolgsrate, jedoch mit zunehmender Liegedauer des Stens auch zu gehäuften Komplikationen wie Stentdislokation, Stentokklusion oder gar Stentbruch. Reinterventionen sind bei ca. einem Drittel der Patienten notwendig bei einer medianen Offenheit des Stents von etwa 150 Tagen (Sasaki et al. 2019 World J Gastroenterol 22(14):3837, Vanella et al. 2023 Gastrointest Endosc 98(3):337). Darum wird die Stentanlage in der europäischen Leitlinie nur noch bei Patienten mit einer Lebenserwartung von maximal einem halben Jahr empfohlen (Van Wanrooij et al. 2022 Endoscopy 54(11):1023). Als Alternative erwies sich die chirurgisch angelegte Gastroenterostomie als Kurzschlussverbindung zwischen Magen und Jejunum dem Stent gegenüber überlegen bezüglich Symptomkontrolle, Offenheits- und Reinterventionsrate (Van Wanrooij et al. 2022 Endoscopy 54(11):1023). Allerdings beinhaltet das chirurgische Vorgehen auch einige Nachteile: bei ausgeprägter Peritonealkarzinose ist die Wundheilung erschwert, die Wiederaufnahme einer oralen Kost kann mehrere Tage dauern und eine Chemotherapie ist erst nach Heilung der Anastomosen, im Mittel nach 3-5 Wochen wieder möglich.
Hier bietet die endosonographisch gesteuerte Anlage einer Gastroenterostomie (EUS-GE) mithilfe eines lumen-apposing metal stents (LAMS) eine gute Alternative. Meist in Analgosedierung durchführbar, führt die EUS-GE zu einem Kostaufbau innerhalb von 1-3 Tagen und ermöglicht aufgrund der geringeren Invasivität eine Chemotherapie bereits nach 2 Wochen – nach unserer Erfahrung teilweise sogar schon nach 5 Tagen. Und das bei vergleichbarem technischen Erfolg wie die chirurgische Methode (Abbas et al. 2022 Endoscopy 54(7):671, Canakis et al. 2023 Gastrointestinal Endosc 98(3):348).
Allerdings erfordert die EUS-GE ein hohes Maß an endoskopischer Expertise und viel Erfahrung in der interventionellen Endosonographie. Der klinische Erfolg der EUS-GE liegt dann bei ca. 90% (Iqbal et al. 2020 Endosc Ultrasound 9(1):16). Zu Beginn muss die Magenausgangsstenose mit einem Draht passiert werden, um hierüber einen Ballon in den freien Teil des Duodenums oder proximalen Jejunums hinter die Engstelle zu schieben. Hierüber erfolgt die Wasserfüllung der Dünndarmschlinge. Mit einem Sektorscanner kann vom Magen aus der Ballon und die dazugehörige Dünndarmschlinge gut identifiziert und somit eine Fehlplatzierung des LAMS in eine Dickdarmschlinge vermieden werden. Die Wasserfüllung des Dünndarms schafft genug Platz, um mit einem Kauterisierungssystem mit aufgeladenem Stent durch die Magen- und Dünndarmwand in das Dünndarmlumen zu brennen. Hier wird die distale Tulpe des Stents entfaltet, die Dünndarmschlinge an den Magen herangezogen und die proximale Tulpe im Magenlumen freigesetzt. Nun besteht eine Anastomose zwischen Magen und Dünndarm, ausgekleidet durch den beschichteten LAMS, die zusätzlich rasch mit einer Epithelschicht abgedichtet wird. Durch den LAMS hindurch sind die Zotten des Dünndarms zu erkennen. Bereits einen Tag nach Anlage der EUS-GE erfolgt der langsame Kostaufbau mit Flüssigkost.
Submukosales Tunneln und Endoskopisch Resezieren (STER)
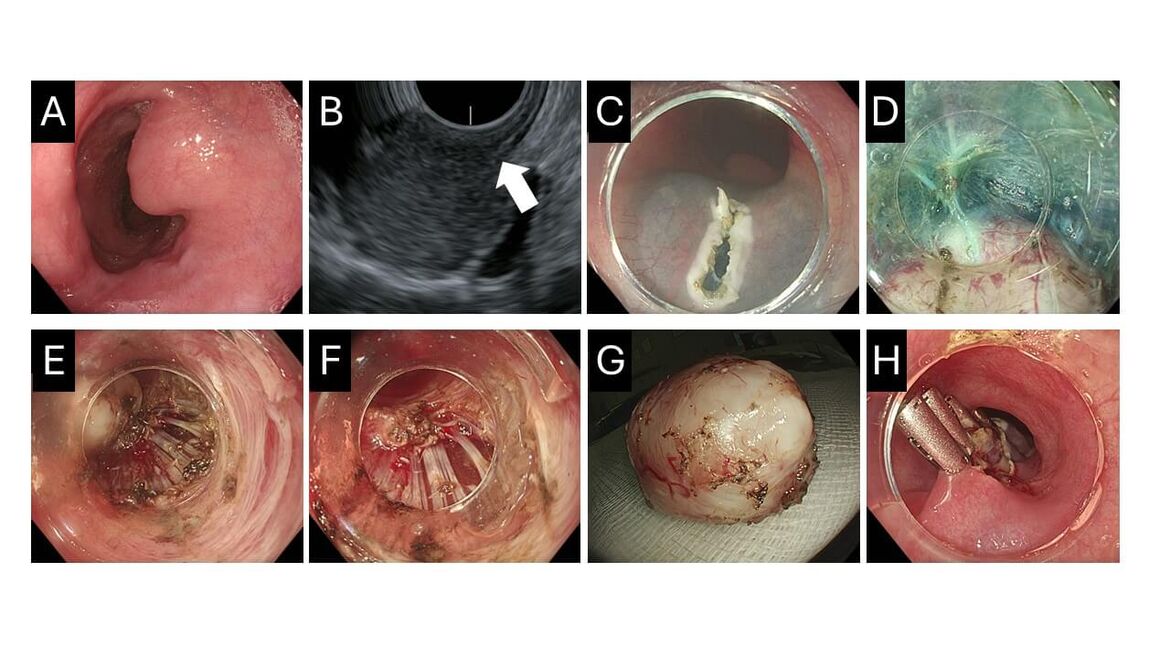
Subepitheliale Tumore des Ösophagus sind zumeist Leiomyome, aber auch in seltenen Fällen GISTs. Symptomatische Leiomyome oder histologisch bestätigte GIST >2cm sollen im Allgemeinen entfernt werden. Bei Befunden im proximalen Ösophagus hat die Operation jedoch erhebliche Konsequenzen und Risiken für den Patienten. Andererseits birgt die endoskopische Eröffnung der Muscularis propria das Risiko einer Perforation und Mediastinitis. Dagegen stellt die STER (Submucosal Tunneling Endoscopic Resection) eine interessante endoskopische Option dar zur sicheren Entfernung gutartiger Prozesse aus der Muskelschicht. Die Methode soll am Beispiel eines asymptomatischen Patienten erläutert werden, der sich wegen eines fast 2cm großen subepithelialen Tumors im oberen Ösophagus vorstellte (A).
Zunächst erfolgte eine Endosonographie mit Nachweis des Ursprungs des Tumors aus der Muscularis propria (BB, Pfeil) sowie die histologische Bestätigung eines GISTs durch eine EUS-gesteuerte Feinnadelpunktion (EUS-FNB). Bei der STER wir ca. 2cm oberhalb des Prozesses nach Unterspritzung ein Einschnitt der Mucosa vorgenommen, ähnlich der POEM (C). Anschließend wird ein Tunnel durch die Submukosa bis zu Läsion präpariert (D) und der GIST vorsichtig aus der Muscularis herauspräpariert (E) und schließlich abgelöst (F). Der GIST wird über den Tunnel herausgezogen (G) und der Tunneleingang mit Clips verschlossen (H). Die Komplikationsrate ist gering. Unser Patient konnte nach 2 Tagen Überwachung entlassen werden. Sein Ösophagus blieb ihm erhalten.
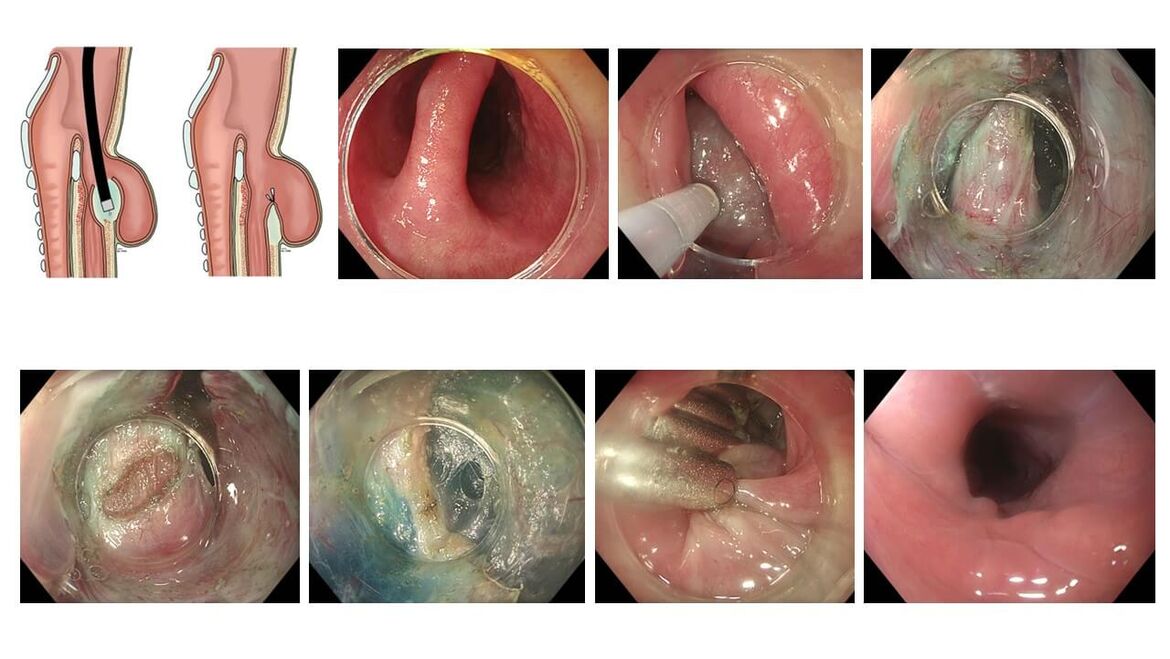
Z-POEM - die Lösung für das Zenker-Divertikel
Das Zenker-Divertikel ist eine Aussackung am Eingang in den Ösophagus. Bei großen Divertikeln können Speise und Tabletten hängenbleiben. Die Patienten leiden dann unter Schluckbeschwerden und einer Regurgitation von Nahrung. Bei der endoskopisch assistierten Divertikulotomie durch den HNO-Arzt muss der Kopf des Patienten maximal überstreckt werden, damit ein starres Endoskop über den Hypopharynx eingeführt werden kann, um den Steg des Divertikels zu durchtrennen. Die klassische offene operativen Entfernung des Divertikels (Divertikulektomie) mit Durchtrennung des oberen Ösophagussphinkters erfolgt der Zugang von außen durch den Hals, wobei die Halsmuskulatur durchtrennt wird. Wichtige Gefäße und Nerven müssen hierbei geschont werden, um Nebenwirkungen zu vermeiden.
Als minimalinvasive Alternative hat sich schon vor vielen Jahren die endoskopische Divertikulotomie etabliert, die mithilfe eines flexiblen Gastroskops ohne eine Überstreckung des Halses erfolgt. Hierbei wird der Divertikelsteg vom Ösophaguslumen aus mit einem Nadelmesser oder einer endoskopischen Schere aufgetrennt. Um eine Eröffnung des darunterliegenden Mediastinums zu vermeiden, wird der Schnitt jedoch manchmal nicht tief genug ausgeführt, sodass Divertikelrezidive nicht selten waren.
Mit der Z-POEM steht eine neue Methode zu Verfügung, die in Abwandlung der gewohnten Tunneltechnik der POEM ebenfalls mit einem flexiblen Gastroskop erfolgt. Hierbei wird die Schleimhaut über dem Divertikelsteg unterspritzt und die Mucosa eingeschnitten. Dann präpariert man sich mit der Endoskopspitze unter der Schleimhaut bis auf den kräftigen Muskel, der entlang eines Tunnels zu Divertikel- und Ösophagusseite freigelegt wird. Nun erfolgt die Myotomie des Stegs unter optischer Kontrolle bis etwas unterhalb des Niveaus des Zenker-Divertikels. Der Eingang des so geschaffenen Tunnels wird am Ende mit Clips verschlossen. Nach ca. 2 Tagen stationärer Überwachung können die Patienten entlassen werden. Da nun der kräftige Muskel fehlt, der zuvor den Divertikelsteg gehalten hat und den Eingang in den Ösophagus verengte, kann das Essen wieder problemlos geschluckt werden. Meist bildet sich die nun muskelfreie Schleimhautfalt unter den Clips zurück, während im Verlauf von wenigen Tagen bis Wochen alle Clips von allein abfallen. Die endoskopische Kontrolluntersuchung nach 2 Monaten zeigt dann eine glatte Passage in den Ösophagus.