Die Bedeutung des Dipeptid-Stoffwechsels
Arbeitsgruppenleitung: Prof. apl. Dr. rer. nat. Verena Peters
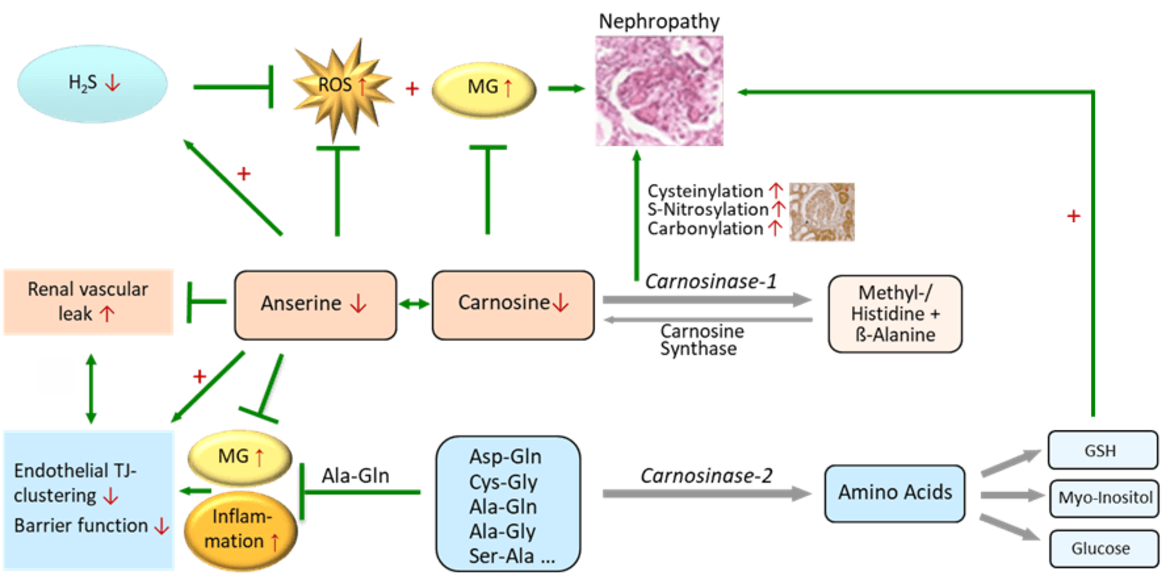
Die Carnosinase 1 (CN1) und Carnosinase 2 (CN2) gehören zu der Gruppe der Dipeptidasen. Während die CN1 histidin-haltige Dipeptide, wie Carnosin, Anserin und Homocarnosin abbaut, baut die CN2 kein Carnosin ab, sondern zahlreiche andere Dipeptide. Die protektive Funktion von Carnosin und Anserin wurde in zahlreichen Studien untersucht, über die physiologische Funktion und der Rolle in Stoffwechselprozessen ist bisher wenig bekannt. Unsere Forschung im Rahmen des Sonderforschungsbereichs (SFB1118) konnte zeigen, dass Dipeptide in der Maus ubiquitär in einem organ-spezifischen Verteilungsmuster, vorkommen. Im CN2-knock out Zellmodell hat der CN2-modulierte Abbau von Dipeptiden eine zentrale Rolle im Aminosäurestoffwechsel inne. Darüber hinaus unterscheiden sich die Dipeptide in ihren Eigenschaften und haben Funktionen, die über ihre Rolle als Aminosäure- Donatoren hinaus gehen. Das renale Dipeptid-Profil in der Niere ist abhängig von der Nierenfunktion. Angestrebt werden innovative therapeutische Ansätze durch Modifikation des organspezifischen Dipeptid-Profils.
Carnosinase 1
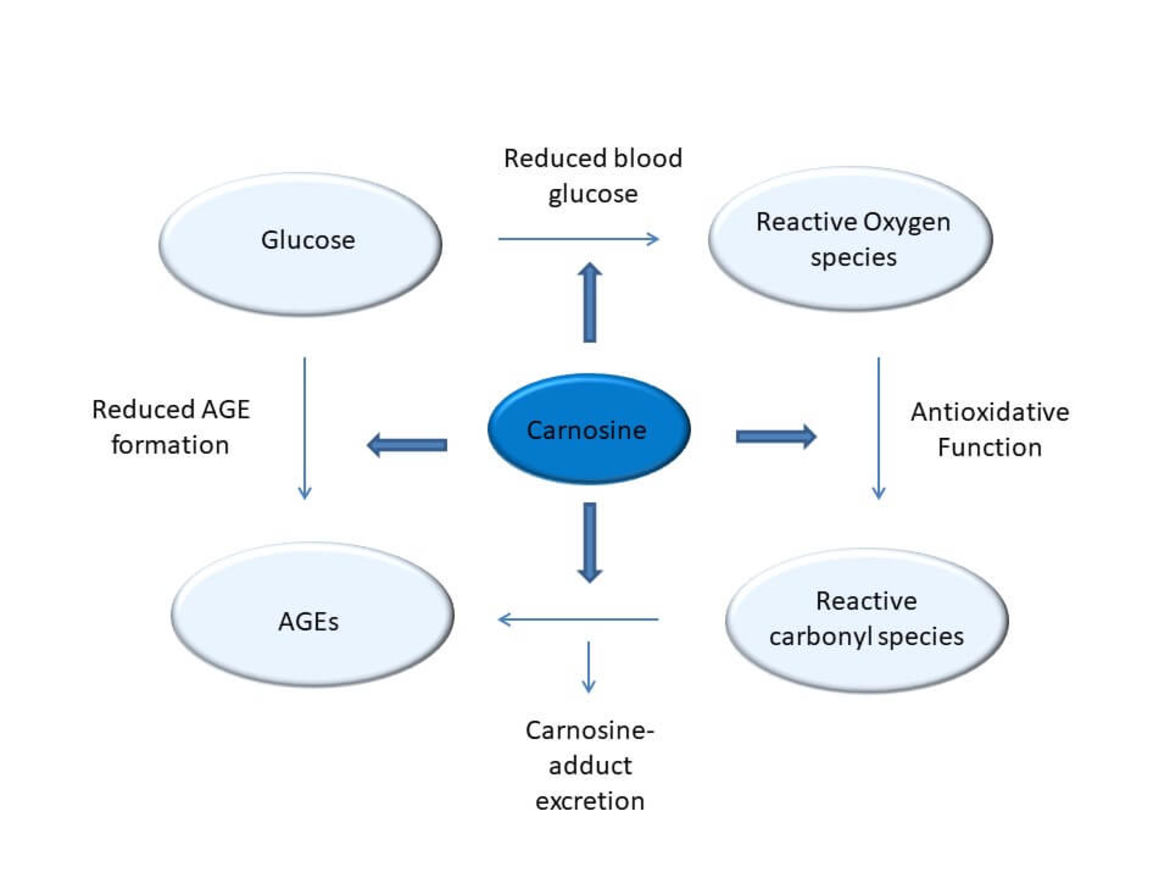
In zahlreichen Zell- und tierexperimentellen Studien konnten wir protektive Effekte von Carnosin hinsichtlich diabetischer Spätschäden nachweisen, die Carnosinase 1 (CN1) spielt eine zentrale Rolle. Darüber hinaus konnten wir zeigen, dass neben Carnosin (Peters et al Curr Med Chem. 2020) auch Anserin (Peters et al. Int J Mol Sci. 2018), die methylierte Form von Carnosin, bei Diabetes nephroprotektiv ist, stärker antioxidativ wirkt und anders als Carnosin vor erhöhter vaskulärer Permeabilität durch Carbonyl- und Inflammations-Stress schützt. Ein knock-out der Carnosinase 1 (Cndp1-KO) schützt Zebrafische bei High Fat Diet vor Übergewicht, das Aminosäureprofil ist modifiziert (Schmöhl et al Cell Mol Life Sci 2019). In der Cndp1-KO Maus sind geschlechtsspezifisch die renalen Gewebe-Konzentrationen von Anserin und Carnosin um das 3- bis 9-fache erhöht (Weigand et al Int J Mol Sci 2020), die max. renale H2S Synthesekapazität verdreifacht (Calabrese et al Antioxidants 2020). Diese Cndp1-KO Mäuse erlauben nun zu differenzieren, inwieweit den in bisherigen Studien beobachteten nephroprotektiven Effekte der beiden Histidin-DP direkte renale oder indirekte systemische Effekte zu Grunde liegen.
Carnosinase 2
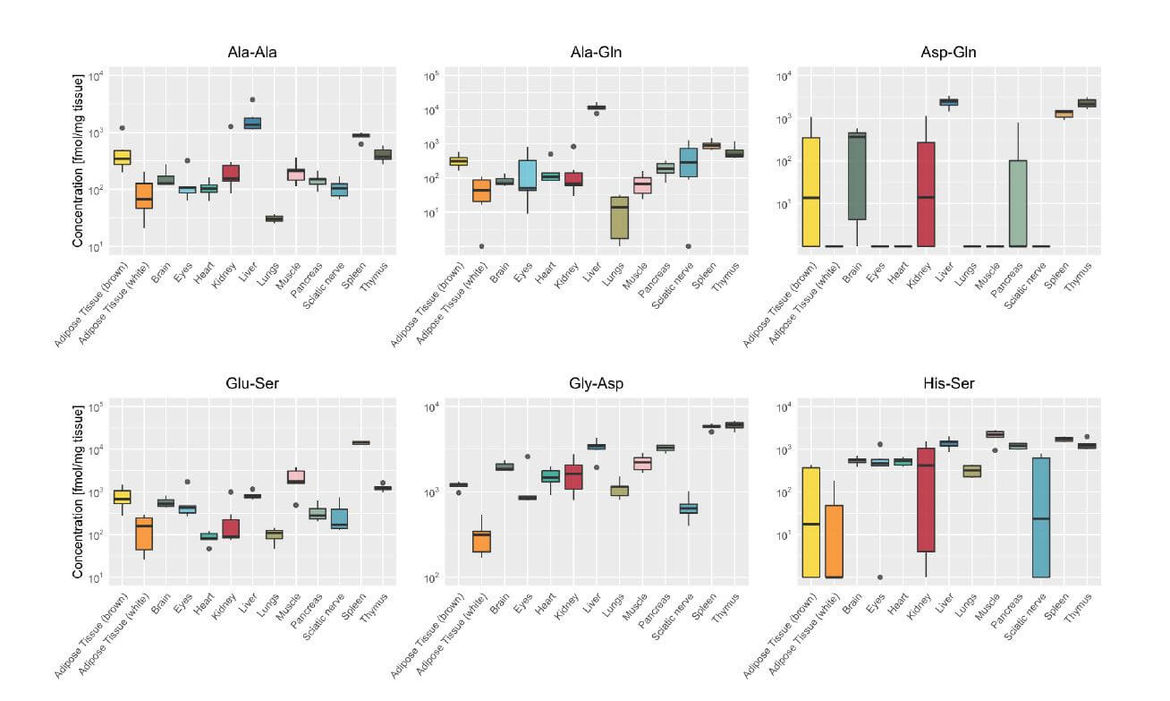
Neben Carnosin und Anserin sind zahlreiche weitere Dipeptide im Gewebe nachweisbar. In der Maus unterscheiden sich die Dipeptid-Profile organspezifisch bezüglich Konzentration und Isomerie (Heidenreich et al Int J Mol Sci 2021) und lassen sich therapeutisch beeinflussen. Die Carnosinase 2 (CN2) baut weder Anserin noch Carnosin ab, jedoch zahlreiche andere DP. Auf diesen Befunden aufbauend wird nun systematisch die organspezifische Abundanz CN1- und CN2- abhängiger und unabhängiger Dipeptide untersucht, die entsprechende Enzymaktivität quantifiziert und der Zusammenhang mit dem Ausmaß diabetischer Spätschäden korreliert, insbesondere mit der diabetischen Nephropathie und Vaskulopathie. Alanyl-Glutamin schützt vor endothelialer Junction-Desintegration und vaskulärer Hyperpermeabilität durch reaktive Metabolite (Bartosova et al Biomolecules 2020); eine Reduktion diabetischer Vaskulopathie bei therapeutischer Supplementation des DP ist denkbar. In zellulären- und Maus- CNDP2 Knock-Out Modellen wird die Rolle der CN2 hinsichtlich DP-Akkumulation, Aminosäuren-Profil und pathophysiologisch relevanten Stoffwechselprozessen sowie Zell- bzw. Organ spezifischen Funktionen untersucht. Angestrebt werden innovative therapeutische Ansätze zur Behandlung diabetischer Spätschäden.
Ausgewählte Publikationen
Heidenreich E, Pfeffer T, Kracke T, Mechtel N, Nawroth P, Hoffmann GF, Schmitt CP, Hell R, Poschet G, Peters V (2021) A novel UPLC-MS/MS method identifies organ specific dipeptide profiles Int J Mol Sci; 22:9979.
Weigand T, Colbatzky F, Pfeffer T, Garbade SF, Klingbeil K, Colbatzky F, Becker M, Zemva J, Bulkescher R, Schürfeld R, Thiel C, Volk N, Reuss D, Hoffmann GF, Freichel M, Hecker M, Poth T, Fleming T, Poschet G, Schmitt CP, Peters V (2020) A Global Cndp1-Knock-Out Selectively Increases Renal Carnosine and Anserine Concentrations in an Age- and Gender-Specific Manner in Mice. Int J Mol Sci; 21:4887.
Calabrese V, Scuto M, Salinaro AT, Dionisio G, Modafferi S, Ontario ML, Greco V, Sciuto S, Schmitt CP, Calabrese EJ, Peters V (2020). Hydrogen Sulfide and Carnosine: Modulation of Oxidative Stress and Inflammation in Kidney and Brain Axis. Antioxidants 18;9(12):1303.
Peters V, Yard B, Schmitt CP (2020). Carnosine and Diabetic Nephropathy. Curr Med Chem.27(11):1801-1812.
Schmöhl F, Peters V, Schmitt CP, Poschet G, Büttner M, Li X, Weigand T, Poth T, Volk N, Morgenstern J, Fleming T, Nawroth PP, Kroll J (2019) CNDP1 knockout in zebrafish alters the amino acid metabolism, restrains weight gain, but does not protect from diabetic complications. Cell Mol Life Sci. 76:4551-4568.
Qiu J, Hauske SJ, Zhang S, Rodriguez-Niño A, Albrecht T, Pastene DO, van den Born J, van Goor H, Ruf S, Kohlmann M, Teufel M, Krämer BK, Hammes HP, Peters V, Yard BA, Kannt A (2019) Identification and characterisation of carnostatine (SAN9812), a potent and selective carnosinase (CN1) inhibitor with in vivo activity. Amino Acids.51(1):7-16.
Peters V, Calabrese V, Forsberg E, Volk N, Fleming T, Baelde H, Weigand T, Thiel C, Trovato A, Scuto M, Modafferi S, Schmitt CP (2018) Protective Actions of Anserine Under Diabetic Conditions. Int J Mol Sci 19:2751.
Weigand T, Singler B, Fleming T, Nawroth P, Klika KD, Thiel C, Baelde H, Garbade SF, Wagner AH, Hecker M, Yard BA, Amberger A, Zschocke J, Schmitt CP, Peters V (2018) Carnosine Catalyzes the Formation of the Oligo/Polymeric Products of Methylglyoxal. Cell Physiol Biochem. 46(2):713-726.
Peters V, Schmitt CP, Weigand T, Klingbeil K, Thiel C, van den Berg A, Calabrese V, Nawroth P, Fleming T, Forsberg E, Wagner AH, Hecker M, Vistoli G. (2017) Allosteric inhibition of carnosinase (CN1) by inducing a conformational shift. J Enzyme Inhib Med Chem. 32:1102-1110
Peters V, Kebbewar M, Janssen B, Hoffmann GF, Möller K, Wygoda S, Charbit M, Fernandes-Teixeira A, Jeck N, Zschocke J, Schmitt CP, Schäfer F, Wühl E; ESCAPE Trial Group (2016). CNDP1 genotype and renal survival in pediatric nephropathies. J Pediatr Endocrinol Metab. 29(7):827-33.
Mitarbeiter
Arbeitsgruppenleiterin
Med.-techn. Laborassistentin
Doktoranden/-innen

Kooperationen
Prof. Dr. Claus Peter Schmitt, Zentrum für Kinder- und Jugendmedizin Heidelberg
Prof. Dr. Benito Yard, Klinikum Mannheim
Prof. Dr. Johannes Zschocke, Humangenetik Innsbruck, Österreich
Prof. Dr. Vittorio Calabrese, Catania, Italien