- Sektion Sepsis & Systemische Inflammation
- Sektion Notfallmedizin
- Sektion Schmerzmedizin
- Forschungsschwerpunkte
-
Arbeitsgruppen
- Airwaymanagement
- Akutes respiratorisches Versagen, lungenprotektive Beatmung und extrakorporale Eliminationsverfahren
- Antiinfektive Therapie und Antibiotic Stewardship
- Epigenomik der Sepsis
- Gehirn: Kognition, Stress und Inflammation
- Hämostaseologie, Hämodynamik und septische Immunmodulation
- Immunmetabolismus & Epigenetik in (systemischen) Immunreaktionen
- Neue diagnostische Wege zur Infektionsdetektion in der induzierten Immunsuppression
- Nosokomiale Infektionen und fungale Immunität
- Postpunktionskopfschmerz
- Translational Research in Pain
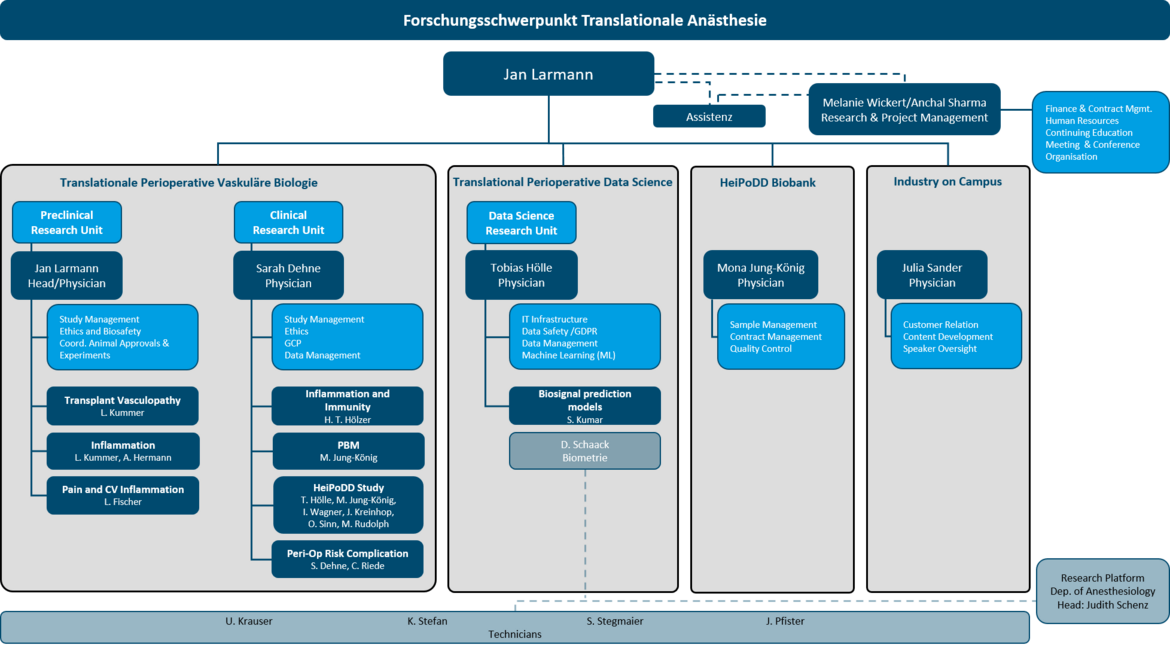
Translationale Anästhesiologie
Weltweilt erleiden mehr als 17% der Patienten, die sich einer nicht-herzchirurgischen Operation unterziehen, relevante perioperative Komplikationen. Diese Komplikationen sind mit einer gesteigerten Morbidität und Mortalität assoziiert (Pearse et al., BJA 2016) und treten besonders häufig bei Hochrisikopatienten auf. Unterschiedliche Komplikationen wie Wundinfektionen, Gerinnungsstörungen, Organdysfunktionen oder kardiovaskuläre Ereignisse sind mit einer Inflammationsreaktion vergesellschaftet und haben gemeinsame immunologische und zellbiologische Ursachen.
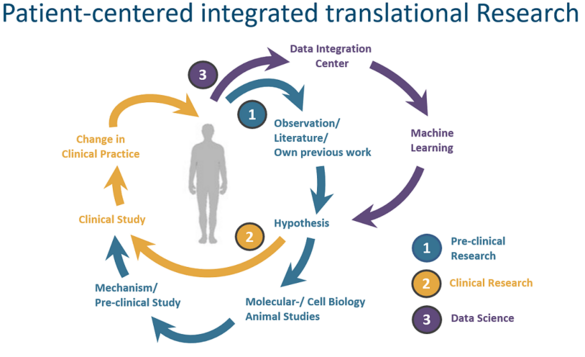
Wir untersuchen in einem jungen, interdisziplinären Team, gemeinsam mit multinationalen Kooperationspartnern, die bisher nur unzureichend verstandenen inflammatorischen Mechanismen, die diesen Erkrankungen zu Grunde liegen. Unser Ziel ist es, die individuelle Belastung unserer Patienten:innen durch perioperative Komplikationen zu reduzieren. Mit Hilfe molekularer- und zellbiologischer Methoden sowie aufwändiger Tiermodelle entwickeln und testen wir Möglichkeiten zu Prophylaxe und Therapie perioperativer kardiovaskulärer Ereignisse. In klinischen Studien überprüfen wir Strategien zur Identifikation von Risikopatienten und testen Ansätze zur Prophylaxe perioperativer Komplikationen.
Arbeitsgruppen Translationale Anästhesiologie
a. Translationale Perioperative Vaskuläre Biologie
Die Verkalkung von Butgefäßen ist eine Erkrankung die viele Menschen vor einer Operation betrifft. Sie stellt ein Risiko für Komplikationen während und nach einer Operation da. Daher sollen durch biologische Modelle die Pathomechanismen besser verstanden werden um dann in klinischen Studien neue Therapiemöglichkeiten zu evaluieren.
b. Translationale Perioperative Data Science
Translationale Perioperative Data Science:
Um das individuelle Risiko eines Patienten für Komplikationen schon vorder Operation möglichst genau abschätzen und berücksichtigen zukönnen, wollen Wissenschaftler des Universitätsklinikums HeidelbergMethoden des „Maschinellen Lernens“ nutzen. Im Rahmen des Projekts„Kognitiver medizinischer Assistent (KoMed)“ wird ein interdisziplinäresTeam der Kliniken für Anästhesiologie sowie für Allgemein-, Viszeral-und Transplantationschirurgie in den kommenden zwei Jahren einenAlgorithmus darin trainieren, eine Vielzahl klinischer Daten vonPatienten mittels Big-Data-Analysen auszuwerten. Ziel ist es, in denDaten Muster zu erkennen und Zusammenhänge zu identifizieren, diezur Erstellung individueller Risikoprofile genutzt werden können. Dergemeinsam mit industriellen Partnern entwickelte KoMed soll zukünftigeine fundierte Entscheidungshilfe bieten, um Komplikationen durch eineangepasste Behandlung und Versorgung zu vermeiden.
Algorithmen des Maschinellen Lernens (ML) finden in den letzten Jahren vermehrt Einsatz im medizinischen Umfeld. Die fortlaufenden technischen Fortschritte in Speicherkapazität und Rechnerleistung bieten die Möglichkeit der Nutzung von ML im perioperativen Setting. In der Fachliteratur konnte eine Überlegenheit von ML Algorithmen gegenüber konventionellen Modellen zur Vorhersage perioperativer Komplikationen nachgewiesen werden. Im Rahmen des HeiPoDD-Projektes werden Patientendaten prospektiv gesammelt mit dem Ziel, durch diesen Datensatz und „erklärbarer künstlicher Intelligenz“ neue Modelle zur perioperativen Risikoidentifikation und vorhersage zu entwickeln.
BioBank
Heidelberg Perioperative Deep Data Registry and Biomaterial Biobank - HeiPoDD
Für wissenschaftliches Arbeiten im Rahmen der perioperativen Patientenversorgung sind umfangreiche und vollständige Datensätze unabdingbar. Hierzu wurde die Heidelberg Registerdaten- und Biobank etabliert, um eine effektive Erhebung und Speicherung von Biobank-Proben und perioperativen Patientendaten in einer umfassenden Datenbank zu gewährleisten. Es werden Biomaterial-Proben und Routinedaten von Patienten, die sich großen chirurgischen Eingriffen unterziehen, nach vorheriger Einwilligung in die Datenbank aufgenommen.
Hier werden bis zu 92 Proben (u.a. Plasma/RNA/DNA/Urin) von knapp 650 Patienten gelagert, so dass sich aktuell ca. 51.500 Proben in der Biobank befinden. Diese Proben sind über ein medizinisches Dateninformationszentrum (MeDIC) mit einer umfangreichen Datenbank aus Routinedaten (Laborwerte, Schnittbildgebung, Medikation, intraoperative Daten zu OP-Verlauf und Hämodynamik sowie perioperativem Outcome und Komplikationen) kombiniert. Die Patienten werden nach ihrem stationären Aufenthalt bis zu 5 Jahre nachüberwacht und der bestehende Datensatz wird um Follow-Up-Daten ergänzt, so dass auch über das perioperative Setting hinaus Informationen eingeschlossen werden können. Diese übergreifende Datensammlung ermöglicht unter anderem Projekte im Bereich des Maschinellen Lernens und Künstlicher Intelligenz, um zum Beispiel perioperative Risikoabschätzung und Entscheidungshilfen im klinischen Alltag möglich zu machen.
Leiter Forschungsschwerpunkt
Mitglieder des Forschungsschwerpunkts
- Arbeitsgruppenleiter
- Wiss. Mitarbeiter/-innen
- Medizinische Doktoranden/-innen
- Alumni
- Administration
- Organigramm

Dr. med. Anna Scholz
Still- und Laktationsberaterin, IBCLC (International Board Certified Lactation Consultant)
DEGUM I gynäkologische und perinatale Sonographie
DEGUM I Mammasonographie
AG-CPC-Kolposkopiediplom
Sicherheits- und Katastrophenschutzbeauftragte

Dr. med. Henrike Janßen
Icahn School of Medicine
Themen
AnCHor-Studie
Outcome nach intraoperativem Wechsel des Anästhesisten – Pilotstudie zu Machbarkeit und Effekten einer Übergabecheckliste
Im Klinikalltag kommt es regelhaft während Narkosen zu einem Wechsel des betreuenden Anästhesisten mit der Notwendigkeit einer Übergabe, die alle relevanten Informationen bezüglich des Patienten und dem Stand der OP beinhaltet. Retrospektive Analysen zeigen, dass solche Wechsel einen negativen Einfluss auf das Patientenoutcome haben. Es gibt Empfehlungen, diese Übergabe nach einem strukturierten Schema durchzuführen. Ob ein solches Schema im Sinne einer Checkliste einen Einfluss auf das Patientenoutcome hat, wurde bisher in diesem Rahmen noch nicht untersucht.
Ziel der Studie ist es Informationen zur Machbarkeit und Daten zu Effektgröße und zugehörigen Streuungsmaßen einer konfirmatorischen, prospektiven, multizentrischen, Vorher-Nachher-Studie zu erheben, die die Frage beantwortet:Verringert eine standardisierte Checkliste für intraoperative anästhesiologische Patientenübergaben die Rate an postoperativen Komplikationen?
(Studientyp: Prospektive, monozentrische, Vorher-Nachher-Beobachtungsstudie)
(Julia Sander; Doktorand: Timon Streiter)
Die Rolle der HO-1 bei Transplantatvaskulopathie
Häm Oxygenase als ein therapeutisches Target bei der anti-HLA Antikörper-vermittelten Transplantatvaskulopathie
In dem DFG-geförderten Projekt „Häm Oxygenase als ein therapeutisches Target bei der anti-HLA Antikörper-vermittelten Transplantatvaskulopathie“ untersuchen wir den Einfluss des anti-inflammatorischen Enzyms HO-1 auf die Entstehung und Entwicklung der Transplantatvaskulopathie. In verschiedenen in vitro Experimenten modulieren wir die Aktivität und das Expressionsniveau der HO-1 in Endothelzellen, um in nachfolgenden funktionalen Assays die Auswirkungen auf die Adhäsion und Transmigration von Monozyten sichtbar zu machen. Durch das Screenen verschiedener Adhäsionsmolekülen auf molekularbiologischer und proteinbiochemischer Ebene versuchen wir den zugrundeliegenden Mechanismus besser zu verstehen. Um unsere gesammelten Ergebnisse in vivo zu verifizieren, haben wir ein heterotopes Aortentransplantationsmodell in Mäusen etabliert. Hierbei wird zwischen genetisch unterschiedlichen Mausstämmen ein Stück Aorta transplantiert und durch die Applikation des entsprechenden Antikörpers die Transplantatvaskulopathie induziert. Dieses äußerst komplexe Tiermodell ermöglicht es uns die protektive Wirkung der HO-1 und weitere therapeutische Ansätze zu untersuchen.
(Laura Kummer)
Bedeutung regulatorischer T-Zellen in der durch perioperativen Stress vermittelten Destabilisierung atherosklerotischer Plaques
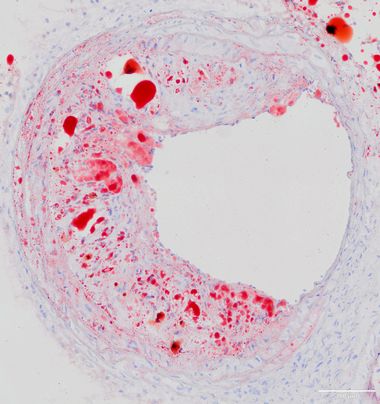
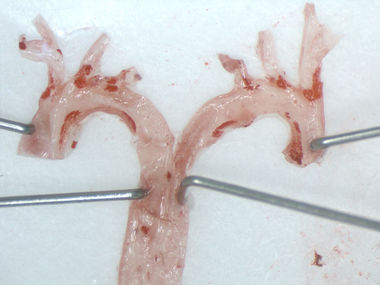
Kardiovaskuläre Komplikationen sind eine der häufigsten Ursachen für perioperative Morbidität und Letalität nach nicht-kardiochirurgischen Operationen. Die zugrundeliegenden Mechanismen perioperativer Plaquerupturen sind unvollständig verstanden. Aus früheren Untersuchungen in atherosklerotischen Mäusen geht jedoch hervor, dass die im Rahmen eines operativen Eingriffes auftretenden immunologischen Vorgänge die Progression und Destabilisierung vorbestehender atherosklerotischer Plaques bedingen. Darüber hinaus beobachteten wir in einer klinischen Studie, dass präoperativ niedrige regulatorische T-Zelllevel mit einem erhöhten Risiko für perioperative kardiovaskuläre Ereignisse korrelieren.
Ziel des Projektes ist es, einen möglichen kausalen Zusammenhang präoperativer regulatorischer T-Zelllevel mit der perioperativ zunehmenden atherosklerotischen Plaquevulnerabilität im Mausmodell für perioperativen Stress zu untersuchen sowie die mechanistische Grundlage mit Hilfe histomorphometrischer, zell- und molekularbiologischer Untersuchungen abzuleiten.
(Jessica Handke)
KoMed
Der Kognitive medizinische Assistent (KoMed) - Entscheidungsunterstützung durch KI auf höchster Datenqualität
Im perioperativen Umfeld fallen an jedem Behandlungstag hohe Volumina an unstrukturierten Daten an. Die Nutzbarmachung solcher Datenquellen aus der Regelversorgung und ihre Integration mit spezifischen, im Rahmen von Studien erhobenen Forschungsdaten, bildet die Grundlage für eine hoch-aufgelöste Charakterisierung des perioperativen Behandlungspfades. Im Rahmen der KoMed-Studie wird gemeinsam mit Partnern am Universitätsklinikum Heidelberg (die Klinik für Allgemein-, Viszeral-, und Transplantationschirurgie, das Institut für Medizinische Biometrie und Informatik, die Abteilung Medizinische Informationssysteme und das Zentrum für Informations- und Medizintechnik), sowie Partnern aus der Industrie (Mint Medical GmbH, Philips Medizin-Systeme Böblingen GmbH, KARL STORZ SE & Co. KG und phellow seven GmbH) zum ersten Mal ein derart umfangreicher, detaillierter Datensatz zur Weiterverarbeitung in der Wissenschaft aufbereitet. Die konzertierte Erhebung wird dabei durch die integrierte IT-Umgebung des Neubaus der Chirurgischen Klinik am Uniklinikum Heidelberg ermöglicht. Die entstehende Pipeline für die multimodalen Datenquellen wird die Basis für die Arbeit mit Methoden des maschinellen Lernens an der Klinik für Anästhesiologie darstellen. Ziel des Projektes ist die Entwicklung einer klinischen Unterscheidungsunterstützung in Form eines algorithmischen Werkzeugs zur Risikostratifizierung und Vorhersage postoperativer Komplikationen.
(Projektleiter Dr. med. Jan Larmann, Ph.D., Stellv. Projektleiter Prof. Dr. med. Pascal Probst)
(Wissenschaftler: Dr. med. Christian Niklas, Sachin Kumar, Laura Kummer, Balavivek Sivanantham)
Assoziation von perioperativer Prothrombinkomplexkonzentrat- und Fibrinogengabe und thrombotischen Komplikationen bei Patienten nach Lebertransplantation
Eine Lebertransplantation stellt für Lebererkrankungen im Endstadium oftmals die einzig kurative Therapieoption dar. In Anbetracht der Organknappheit und der mit einer Retransplantation einhergehenden erhöhten Morbidität und Mortalität für den Patienten hat die Vermeidung von Komplikationen im Rahmen einer (Leber-)Transplantation besonderen Stellenwert.
Eine ausgesprochen gefürchtete Komplikation stellen Thrombosen der Arteria hepatica (Leberarterie), Pfortader und der Vena Cava dar. Hierfür konnte eine Vielzahl an Risikofaktoren identifiziert und in der Literatur beschrieben werden. Allerdings wurde bisher nicht untersucht, ob die Substitution bestimmter Gerinnungsfaktoren (Prothrombinkomplexkonzentrat, kurz PPSB, und Fibrinogenkonzentrat) im perioperativen Zeitraum eine Rolle bei der Entstehung von Thrombosen der Arteria hepatica, der Pfortader oder der Vena cava inferior (untere Hohlvene) spielt. Die Substitution dieser Blutprodukte wird durch die eingeschränkte Synthesefunktion aufgrund der zugrundeliegenden Lebererkrankung oftmals notwendig.
Dies wird in einer monozentrischen, retrospektiven Studie untersucht, um den möglichen, oben genannten, Zusammenhang genauer zu analysieren und so zu einem besseren Verständnis von perioperativen thrombotischen Komplikationen bei Lebertransplantationen beizutragen.
(Dr. med. Sarah Dehne; Doktorand: Carlo Riede)
Assoziation von perioperativer inspiratorischer Sauerstoffkonzentration und tumorfreiem Überleben nach elektiven onkologischen Operationen
Eine erhöhte inspiratorische Sauerstoffkonzentration (FiO2) wird in der Anästhesie, der Intensivmedizin und der Notfallmedizin häufig verwendet. Während einer Allgemeinanästhesie wird der Patient, in Abhängigkeit vom Bedarf des Patienten, der Art des chirurgischen Eingriffs sowie der Präferenz des Anästhesisten mit einer FiO2 zwischen 30% und 100% beatmet. In dieser Studie untersuchen wir, ob eine hohe FiO2 bei elektiven onkologischen Operationen den weiteren Krankheitsverlauf von Tumorpatienten beeinflusst. 1084 Patienten mit kolorektalem, pankreatischen und hepatozellulärem Karzinom, die im Zeitraum zwischen 01/2009 und 12/2016 in der Chirurgischen Klinik des Universitätsklinikums Heidelberg operiert wurden, wurden in die Studie eingeschlossen. Der primäre Endpunkt ist tumorfreies Überleben im Beobachtungszeitraum von der Indexoperation bis zum längsten verfügbaren Follow-up. Wir haben den mittleren FiO2-Wert während der Operation für jeden Patienten berechnet und analysieren Daten über den weiteren Krankheitsverlauf. Die Patienten werden entsprechend ihrer FiO2-Werte in zwei Gruppen eingeteilt und hinsichtlich des tumorfreien Überlebens mittels Kaplan-Meier-Analyse verglichen.
(Dr. med. Sarah Dehne; Doktorandin: Verena Spang)
POPART-CVO-Studie
Assoziation von perioperativer Aspirin-Resistenz und kardiovaskulärem Outcome
Bis zu 8 bis 13% der nicht-herzchirurgischen Patienten erleiden perioperativ teils schwere kardiovaskuläre Komplikationen wie Myokardinfarkte, Arrhythmien oder Lungenembolien, auf welche mehr als zwei Drittel der perioperativen Mortalität zurückzuführen sind.
Verschiedene Studien konnten bereits das Neuauftreten einer perioperativ gesteigerten Thrombozytenfunktion unter Aspirin-Therapie (Aspirin-Resistenz) zeigen. Ob diese Beobachtung mit oben genannten kardiovaskulären Ereignissen in Verbindung steht ist bisher unklar.
Im Rahmen dieser prospektiven klinischen Beobachtungsstudie wird nun an gefäßchirurgischen Patienten untersucht, ob das Auftreten einer perioperativen Aspirin-Resistenz mit dem Auftreten von kleinen Myokard-Schäden (myocard injury after non-cardiac surgery, kurz: MINS) und daher auch mit einer erhöhten 30-Tage Mortalität assoziiert ist. Außerdem wird geprüft, ob eine neu entstandene Aspirin-Resistenz durch in vitro Zugabe von Aspirin wieder aufgehoben werden kann.
Dieses Projekt wird durch die B. Braun-Stiftung gefördert.
(Dr. med. Sarah Dehne; Doktorand: Christian Heck)
Projekt Förderer Laufzeit Projektleiter Fördersumme | Der Kognitive medizinische Assistent (KoMed) – Entscheidungsunterstützung durch KI auf höchster Datenqualität Ministerium für Wissenschaft, Forschung und Kunst Baden-Württemberg März 2020 – Februar 2022 Dr. Jan Larmann, Ph.D. 2.049.740,00 EUR |
Projekt Förderer Laufzeit Projektleiter Fördersumme | Heme oxygenase-1 as a therapeutic target in anti-HLA antibody-triggered transplant vasculopathy DFG Sachbeihilfe LA 2343/7-1 2015 – 2020 Dr. Jan Larmann, Ph.D. 215.564,00 EUR |
Projekt Förderer Laufzeit Projektleiter Fördersumme | Short-term opioid-mediated effects on atherosclerotic lesion stability Innovationsfonds Frontier der Exzellenzinitiative II des Bundes ZUK 49/2 5.2.159 2016 – 2017 Dr. Jan Larmann, Ph.D. 97.795,00 EUR |
Projekt Förderer Laufzeit Projektleiter Fördersumme | Association of PeriOPerative Aspirin-ResisTance and CardioVascular Outcome (POPART-CVO) B. Braun Stiftung Mai 2020 – November 2021 Dr. med. Sarah Dehne 20.000,00 EUR |
Projekt Förderer Laufzeit Projektleiter Fördersumme | Quantifizierung Regulatorischer T-Zellen im Blut von Hochrisikopatienten vor nicht-kardiochirurgischen Operationen zur Risikostratifizierung für kardiovaskuläre Komplikationen B. Braun Stiftung 2017 – 2018 Jessica Handke 28.000,00 EUR |
Projekt Förderer Laufzeit Projektleiter Fördersumme | MET: REevaluation for Perioperative cArdIac Risk (MET-REPAIR): a prospective, multi–centre cohort study- Presepsin (sCD14-ST) substudy Mitsubishi Chemical Europe GmbH 2018 – 2020 Dr. Jan Larmann, Ph.D. 21.907,26 EUR |
PD Dr. Stephan Immenschuh, Institut für Transfusionsmedizin, Medizinische Hochschule Hannover
Prof. Dr. med. Pascal Probst, Klinik für Allgemein-, Viszeral- und Transplantationschirurgie, Studienzentrum der Deutschen Gesellschaft für Chirurgie; Universitätsklinikum Heidelberg
Dr. med. Rosa Klotz, Klinik für Allgemein-, Viszeral- und Transplantationschirurgie, Studienzentrum der Deutschen Gesellschaft für Chirurgie; Universitätsklinikum Heidelberg
Dr. med. Hannes Kenngott, Klinik für Allgemein-, Viszeral- und Transplantationschirurgie, Universitätsklinikum Heidelberg
Prof. Dr. Markus K. Diener, MBA, Klinik für Allgemein- und Viszeralchirurgie, Universitätsklinikum Freiburg
Prof. Dr. med. Arianeb Mehrabi, Klinik für Allgemein-, Viszeral- und Transplantationschirurgie, Universitätsklinikum Heidelberg
Prof. Dr. med. Martin A. Schneider, Klinik für Allgemein-, Viszeral- und Transplantationschirurgie, Universitätsklinikum Heidelberg
PD Dr. med. Christian Morath, Nierenzentrum Heidelberg, Universitätsklinikum Heidelberg Dr. Anke Tappe-Theodor, Pharmakologisches Institut, Universität Heidelberg
Prof. Dr. med. Evangelos Giannitsis, Klinik für Kardiologie, Angiologie, Pneumologie, Universitätsklinikum Heidelberg
Prof. Dr. med. Dittmar Böckler, Klinik für Gefäßchirurgie und Endovaskuläre Chirurgie, Universitätsklinik Heidelberg
Prof. Dr. Dr. h. c. Markus W. Büchler, Klinik für Allgemein-, Viszeral- und Transplantationschirurgie, Universitätsklinikum Heidelberg
Gerd Schneider M.Sc., Abteilung Medizinische Informationssysteme, Universitätsklinikum Heidelberg
Dr. sc. hum. Oliver Heinze, Abteilung Medizinische Informationssysteme, Universitätsklinikum Heidelberg
Peter Rüdiger, Zentrum für Informations- und Medizintechnik, Universitätsklinikum Heidelberg,
Manuel Feisst, Dorothea Weber, Anja Sander, Johannes Krisam, Institut Medizinische Biometrie und Informatik, Universitätsklinikum Heidelberg
Dr. med. Marcin Zaradzki, Klinik für Herzchirurgie, Universitätsklinikum Heidelberg
Extern
PD Dr. med. Giovanna Lurati Buse, Klinik für Anästhesiologie, Universitätsklinikum Düsseldorf
Dr. Hans-Jörg Gillmann, Klinik für Anästhesiologie und Intensivmedizin, Medizinische Hochschule Hannover
Luis E. Tollinche, MD, Department of Anesthesiology & Critical Care Medicine, Memorial Sloan Kettering Cancer Center, New York
Maximiliano Mollura and Prof. Riccardo Barbieri, Department of Electronics, Information and Bioengineering, Plitecnico di Milano, Italy, affiliated with the Massachusetts General Hospital, the Massachusetts Institute of Technology and the Wyss Insitute for Biologically Inspired Engineering at Harvard Univeristy, Boston
Dr. Marianna Laviola and Prof. Dr. Jonathan G Hardman, Interdisciplinary Collaboration on Systems Medicine, Department of Anesthesia and Critical Care, Faculty of Medicine & Health Science, University of Nottingham, UK
Dr. L. Christian Napp, Kardiologie und Angiologie, Medizinische Hochschule Hannover
Industriepartner
Mitsubishi Chemical Europe GmbH
Mint Medical GmbH
Philips Medizin-Systeme Böblingen GmbH
KARL STORZ SE & Co. KG
phellow seven GmbH
- Sektion Sepsis & Systemische Inflammation
- Sektion Notfallmedizin
- Sektion Schmerzmedizin
- Forschungsschwerpunkte
-
Arbeitsgruppen
- Airwaymanagement
- Akutes respiratorisches Versagen, lungenprotektive Beatmung und extrakorporale Eliminationsverfahren
- Antiinfektive Therapie und Antibiotic Stewardship
- Epigenomik der Sepsis
- Gehirn: Kognition, Stress und Inflammation
- Hämostaseologie, Hämodynamik und septische Immunmodulation
- Immunmetabolismus & Epigenetik in (systemischen) Immunreaktionen
- Neue diagnostische Wege zur Infektionsdetektion in der induzierten Immunsuppression
- Nosokomiale Infektionen und fungale Immunität
- Postpunktionskopfschmerz
- Translational Research in Pain