GMP Labor
Herstellung von Zell-Präparaten
CD19-spezifische CAR-T-Zellen für die HD-CAR1-Studie
Die CAR-T-Zellen für unsere Phase I Studie werden in unserem GMP-Labor erstellt. Es wird ein retroviraler Vektor der dritten Generation mit CD19 als Target und CD28/4-1BB als costimulatorische Domänen eingesetzt. Die erste klinische CAR-T-Zell-Produktion wurde im September 2018 beendet, die erste therapeutische Applikation erfolgte im Oktober 2018. Bisher wurden vier Patienten in der HD-CAR-1 Studie behandelt. Des Weiteren sind Studien geplant, in denen entweder eine optimierte GMP-Produktion untersucht wird, insbesondere bei CLL-Patienten, oder neu entwickelte Vektorsysteme zum Einsatz kommen. Beispielsweise haben wir einen CAR-Vektor gegen CD33 erstellt und stehen zusätzlich in engem Kontakt zu unseren Kollegen aus dem NCT in Heidelberg (Dirk Jäger, Jürgen Krauß), die bereits Konstrukte gegen BCMA oder CD22 entwickelt haben.
“Tolerogene” Myeloid-derived Suppressor Cells (MSCs) für die TOL1-Studie
In Kooperation mit den Kollegen aus der Immunologie und Nephrologie in Heidelberg entwickelten wir in Protokoll zur Erstellung von MDSCs in GMP-Qualität für die klinische Applikation. Diese „tolerogenen“ Zellen werden bei der soliden Organtransplantation eingesetzt. MDSCs entstehen hierbei aus PBMCs von Patienten durch eine Stimulation mit Mitomycin C. Die Zellen werden anschließend dem Patienten zurückgeben, um das Risiko einer Transplantatabstoßung zu verringern. Zusätzlich kann die Notwendigkeit von immunsuppressiven Me-dikamenten deutlich verringert werden. Die Phase I Studie ist bereits abgeschlossen und zeigte erfolgversprechende Resultate. Eine Publikation wird gerade verfasst (Morath C et al. DGHO 2018). Eine Phase II-Studie (TOL-2) mit wiederum MDSCs aus eigener GMP-Herstellung ist in Planung in Kooperation mit Kollegen vom Nierenzentrum Heidelberg (Martin Zeier, Christian Morath und Matthias Schaier).
Herstellung von Peptide-Impfstoffen/Vakzinen
IDH1-Vakzine bei Gliomen (NOA-16-Studie)
In Kooperation mit der Neurologie in Heidelberg erstellten wir IDH1-Vakzine für die NOA-16-Studie in unserem GMP-Labor. In dieser Phase I Studie wurden 32 Patienten mit IDH1R132H-mutierten Grad III/IV Gliomen behandelt. Diese Studie wurde an 6 Zentren in Deutschland durchgeführt. Sicherheit und Immunogenität des Vakzines konnten nachgewiesen werden (Platten M et al. ASCO 2018). In der geplanten NOA-21 (EudraCT 2017-000587-15) wird dieses Vakzin im neoadjuvanten Setting +/- Checkpoint-Inhibitor Avelumab evaluiert.
CMVpp65-Vakzine zur CMV-Prophylaxe
Leider gibt es bisher keinen zugelassenen Impfstoff gegen CMV. Aus diesem Grund entwi-ckelten wir neue Peptid-Vakzine gegen CMVpp65, die wir in GMP-Qualität für unterschiedliche Studien herstellen konnten. Aktuell arbeiten wir an der GMP-gerechten Herstellung von multivalenten CMV-Vakzinen, die neben CD8-positive T-Zellen auch CD4-positive T-Zellen aktivieren können.

GCP / Klinische Prüfstudien
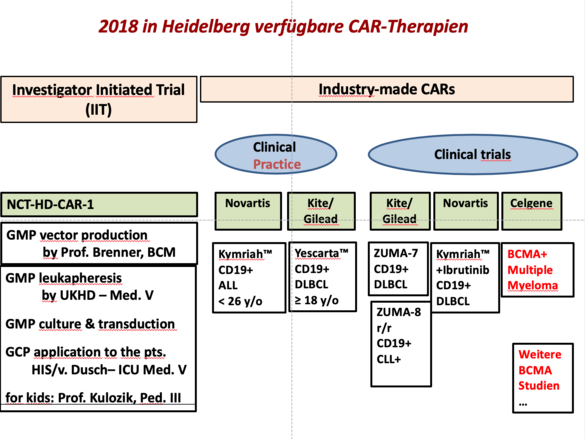
HD-CAR-1-Studie
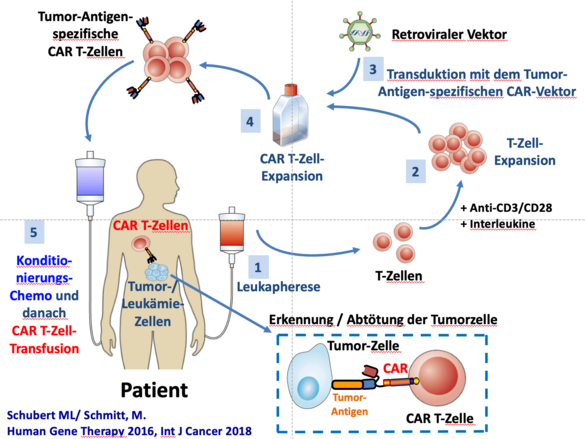
Wir konnten in Heidelberg die erste Deutsche IIT mit CAR T-Zellen initiierten, für die Prof. Schmitt der Leiter der Klinischen Prüfung bin (EudraCT 2016-004808-60). Eingeschlossen werden können Patienten mit unterschiedlichen B-Zell-Neoplasien inklusive ALL, CLL, DLBCL, FL und MCL in letzter Therapielinie. Der erste Patient wird im Oktober behandelt werden. Besonders reizvoll ist an dieser Studie, dass Indikationen außerhalb der bereits zugelassenen Produkte (ALL, DLBCL) therapiert werden können. Zusätzlich erlaubt uns diese Studie ein umfangreiches Begleitforschungsprogramm. Die Gründe für Therapieansprechen oder Therapieversagen werden hierbei im Detail erforscht, um in präklinischen Studien Mechanismen der Therapieresistenz zu identifizieren. Im Gegensatz zu den kommerziellen Produkten können wir in diesem Fall auch das CAR T-Zell-Produkt intensiv charakterisieren. Anschließend können die neuen Erkenntnisse wiederum in einem translationalen Ansatz in unsere GMP-Produktion oder in innovative Studienkonzepte einfließen.

TOL-1-Studie
Aktuell ist bei der soliden Organtransplantation eine lebenslange Immunsuppression notwendig. Dies ist jedoch mit erheblichen Nebenwirkungen assoziiert. Aus diesem Grund ist eine Alternative zur medikamentösen Immunsuppression dringend notwendig. Wir initiierten eine Phase I Studie mit sogenannten „tolerogenen“ MDSCs bei Patienten, die eine Nierentransplantation erhalten haben. In dieser Studie konnte eine erhebliche Reduktion der Immunsuppression erreicht werden (Morath C et al. DGHO 2018).
Zur weiteren Entwicklung dieses Produktes wurde eine Firma ausgegründet (TolerogenixX GmbH). Eine multizentrische Phase II Studie (TOL-2) befindet sich bereits in Planung.
CMVpp65-Peptid-Vakzinierungsstudie
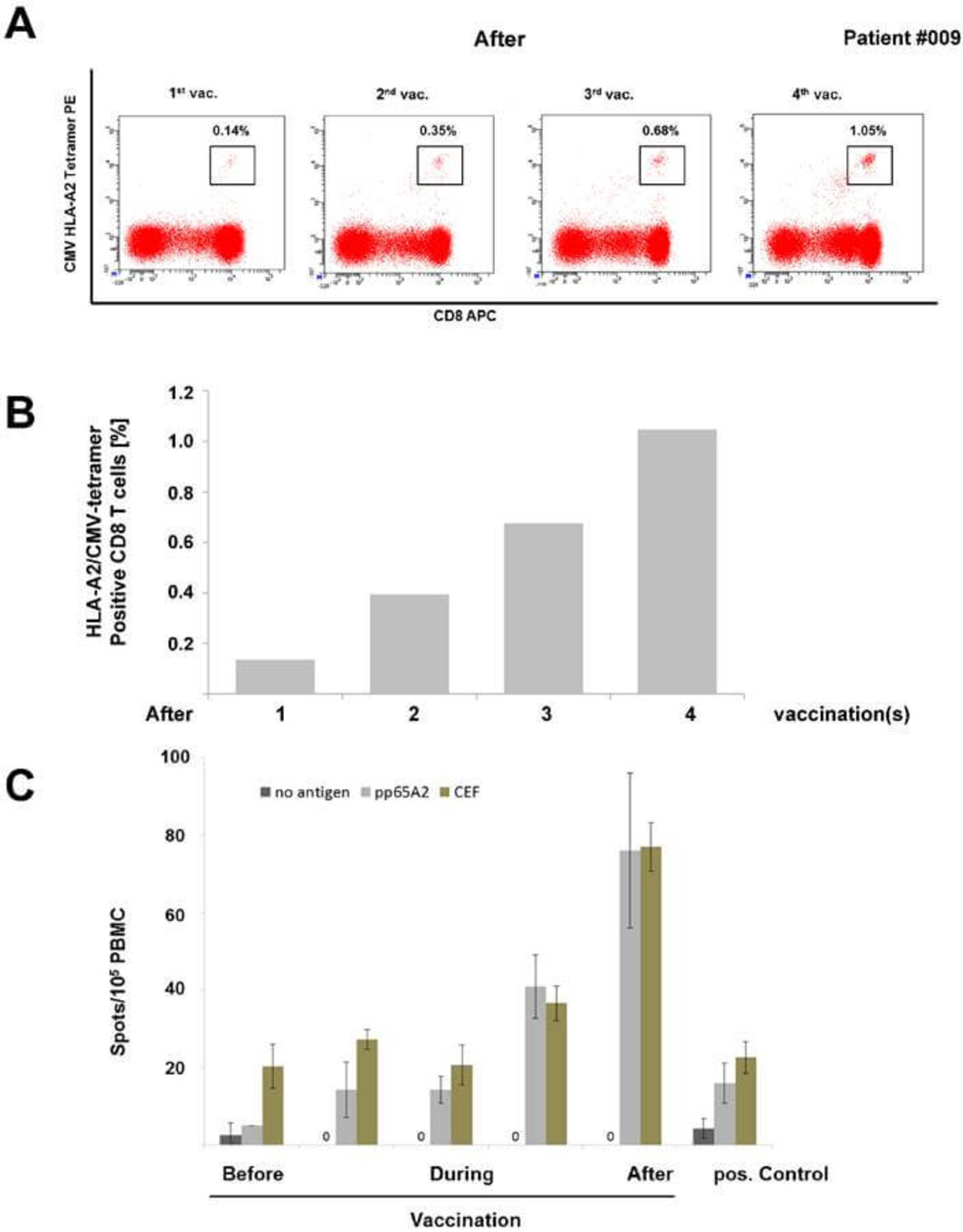
Patienten mit einem CMV-negativen Stammzellspender haben ein deutlich erhöhtes Risiko für eine CMV-Reaktivierung nach allogener Stammzelltransplantation. Eine CMV-Reaktivierung kann bei Patienten nach Transplantation allogener hämatopoetischer Stammzellen oder Solider Organ-Transplantation (SOT) schwere Krankheitsbilder mit Pneumonie, Kolitis, Transplantat-Versagen etc. auslösen. Daher ist die Erzeugung einer Immunantwort gegen CMV höchst wünschenswert. Leider gibt es bisher keinen zugelassenen Impfstoff gegen CMV. Aus diesem Grund entwickelten wir neue Peptid-Vakzine gegen CMVpp65 und stellten diese in unserem GMP-Labor her. In unserer Phase I IIT mit CMVpp65-Vakzinen für Patienten mit CMV-negativem Spender bei der allogenen Stammzelltransplantation konnten wir erfolgversprechenden ersten klinischen Resultate erzielen (Schmitt M et al. Theranostics 2017). Zu-sätzlich haben wir eine Studie zur Peptid-Vakzinierung nach Nierentransplantation durchgeführt (Sommerer et al. in Vorbereitung). In einem weiteren Projekt planen wir in Kooperation mit Immunologen aus Tübingen (Stefan Stevanović und Hans-Georg Rammensee) die Herstellung von multivalenten CMV-Vakzinen, die neben der CD8-Zellantwort auch über MHC II eine CD4-basierte Immunantwort bewirken können. Die dafür verwendeten Epitop-Peptide sind patentiert. Langfristig wird eine multi-virale Peptid-Vakzine gegen CMV, EBV und die Po-lyomaviren BKV/JCV angestrebt. Auch für BKV/JCV haben wir bereits in vitro eine Epitop-Charakterisierung durchgeführt (Mani et al., Oncotarget 2017).