AG Zelluläre Immuntherapie / GMP-Labor
Präklinische CAR-T-Zell-Forschung
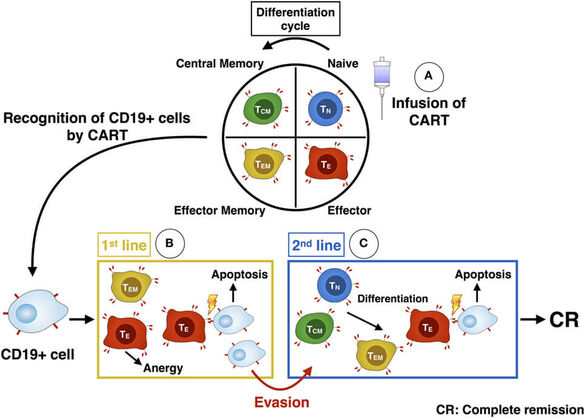
Ein besonderer Schwerpunkt unserer Forschung liegt im Bereich der adoptiven Immuntherapie. Hierbei werden Tumorpatienten gesunde Immunzellen entnommen, ex vivo manipuliert und anschließend den Patienten zurückgegeben. Besonders vielversprechend sind hierbei genetisch veränderte T-Zellen, die rekombinante T-Zell-Rezeptoren (TCRs) oder sogenannte chimäre Antigenrezeptoren (CARs) exprimieren. Mithilfe dieser tumorspezifischen T-Zellen konnten bereits vielversprechende Ansprechraten in unterschiedlichen Tumorentitäten erzielt werden (Schubert et al. Hum Gene Ther 2017; Schubert et al. Int J Cancer 2018). Unser Fokus liegt bei der Optimierung dieser Zelltherapieansätze, um deutlich höhere Ansprechraten und langanhaltende Remissionen erzielen zu können. Hierfür verfolgen wir 2 Ansätze: (1) Optimierung der Zellproduktion und (2) Entwicklung neuer Kombinationstherapien.
(1) Es hat sich gezeigt, dass insbesondere Tumorpatienten T-Zellen mit nur eingeschränkter Funktion besitzen. Auch nach ex vivo-Manipulation können diese nicht ausreichend ihre anti-Tumor-Aktivität entfalten und es kommt zum Therapieversagen. Aus diesem Grund ist eine Optimierung der Herstellungsprotokolle obligat. Weniger differenzierte (naive) T-Zellen (TN)spielen bei der adoptiven T-Zell-Therapie für das Engraftment und die Langzeitpersistenz in vivo eine wichtige Rolle. Wir konnten nachweisen, dass der Einsatz von Retronectin, einem rekombinanten Fibronektin-Fragment, welches hauptsächlich zur Verbesserung des Gentransfers mit retroviralen Vektoren eingesetzt wird, auch zur Anreicherung von weniger differenzierten T Zellen ex vivo führen kann, wenn es zur Aktivierung der T-Zellen am Anfang der Zellkultur verwendet wird (Stock et al. Hum Gene Ther 2018). Gerade bei Patienten mit einer chronischen lymphatischen Leukämie (CLL) ist die Produktion von CAR T-Zellen deutlich erschwert (Hoffmann, et al. Front Immunol 2017). Dies liegt unter anderem am Vorhandensein von Leukämiezellen im peripheren Blut, also im Ausgangsmaterial zur Herstellung von CAR T-Zellen. Zudem weisen T-Zellen von CLL-Patienten einen besonders erschöpften („exhausted“) T-Zell-Phänotyp auf und besitzen eine deutlich kleinere Fraktion an TN-Zellen. Zur Anreicherung von CAR T-Zellen mit TN-Phänotyp konnten wir nachweisen, dass der PI3K-Inhibitor Idelalisib die Differenzierung von T-Zellen unterbinden und TN-Zellen anreichern kann, insbesondere bei der Produktion von CAR T-Zellen mit Immunzellen von CLL-Patienten (Stock et al. ASH 2017). In unserer GMP-Einheit können anschließend die neuen Erkenntnisse im Rahmen einer Zellproduktion für die Anwendung am Patienten evaluiert werden (Wang & Gong et al. submitted).
Zur Entwicklung von neuen Kombinationstherapien mit der adoptiven Immuntherapie erforschen wir die Mechanismen von synergistischen Kombinationspartnern. Aktuell wird u.a. die Kombination von CAR-T-Zellen mit Inhibitoren von anti-apoptotischen Proteinen (z.B. BCL2 und MCL1) im Detail funktionell charakterisiert.
Zur erfolgreichen Tumortherapie sind zuverlässige Biomarker für Therapieansprechen oder Therapieversagen notwendig. Wir haben in Kooperation mit dem Institut für Pathologie in Heidelberg einen Assay entwickelt und evaluiert, der CLL-Patienten anhand der Aktivität von Schlüsselenzymen der Glykolyse in deren Leukämiezellen charakterisieren kann. Wir konnten nachweisen, dass Patienten mit CLL-Zellen, die gut ihren Glukosemetabolismus unter Anoxie adaptieren können, deutlich schlechter auf eine Chemoimmuntherapie ansprechen (Gdynia et al. EBioMedicine 2018).
Definition und Charakterisierung von innovativen Antigen-Strukturen
In der Vergangenheit hat unsere Gruppe intensive Forschungsaktivitäten zur Definition und Charakterisierung von neuen Target-Antigenen unternommen. Beispielsweise haben wir RHAMM als immunologisches Target bei unterschiedlichen hämatologischen Neoplasien charakterisiert und erfolgreich Vakzinierungsstudien gegen RHAMM durchgeführt (Greiner J et al. Blood 2005; Schmitt M et al. Blood 2008). Aktuell definieren wir gerade ein Tumor-assoziiertes Antigen bei Weichteilsarkomen mithilfe einer in silico Prädiktionsplattform für HLA-Motive, welche am DKFZ in Heidelberg entwickelt wurde. Hierbei ist die Isolation von tumor-spezifischen TCRs bestimmter immunogener Peptide geplant. Anschließend können diese rekombinanten TCRs in Vektorsysteme kloniert werden.
Präklinische Forschung zur Graft-versus-Host-Erkrankung (GvHD)
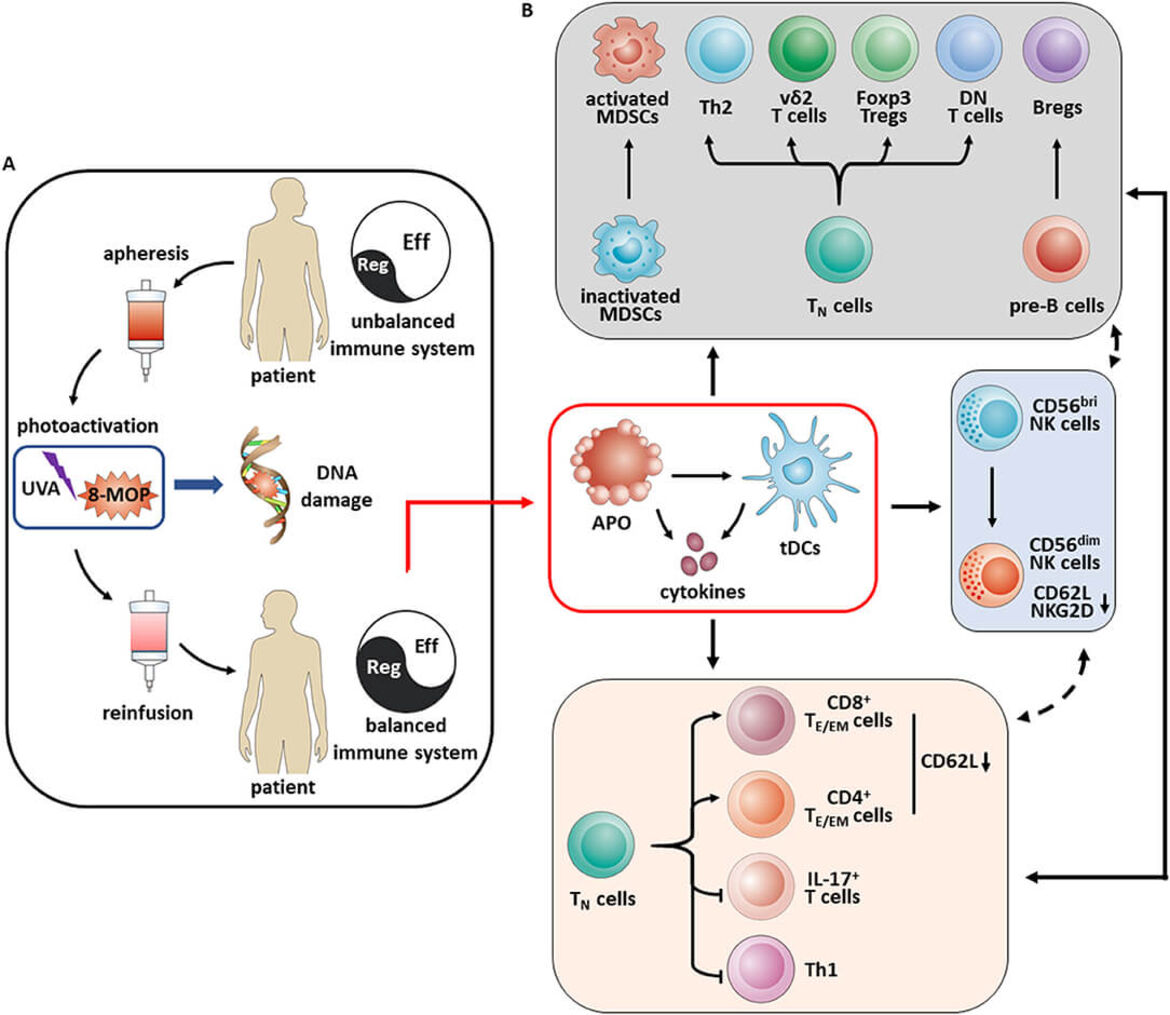
Am Uniklinikum in Heidelberg werden pro Jahr über 100 Patienten allogen transplantiert. Die Graft-versus-Host-Erkrankung (GvHD) ist eine schwere Komplikation der allogenen hämatopoetischen Stammzelltransplantation (allo-HSCT). In ca. 40-80% tritt bei Patienten eine klinisch signifikante akute GvHD (aGvHD) auf. Etwa 35-70% der Patienten entwickeln eine chronische GvHD (cGVHD). Systemische Steroide repräsentieren die First-Line-Therapie. Allerdings sprechen bis zu 60% der Patienten nicht ausreichend auf Steroide an und benötigen eine zusätzliche Behandlung. Eine Zweitlinienbehandlung für GvHD ist die extrakorporale Photopherese (ECP), die gute klinische Ergebnisse aufweist (Lorenz et al. Leukemia and Lymphoma 2015; Wang et al. Frontiers of Immunol 2018).
Um den Patienten diese Therapie zu ermöglichen, wurde 2013 diese immunmodulatorische Therapie der ECP in der Medizinischen Klinik V am Uniklinikum Heidelberg mit unserem Team etabliert. Die Behandlungsindikationen schließen neben der akuten und chronischen GvHD auch die solide Organtransplantation und das kutane T-Zell-Lymphom (CTCL) mit ein. Von anfänglich ca. 60 ECP-Behandlungen pro Jahr sind die Behandlungszahlen um eine Log-Stufe auf knapp 600 ECP-Behandlungen pro Jahr angestiegen. Bei der GvHD wird das Gleichgewicht der Immunzellen zerstört: Effektorzellen werden von regulatorischen Zellen nicht mehr effizient kontrolliert. ECP-Therapie kann dieses Gleichgewicht wiederherstellen. Der genaue Mechanismus und der Einfluss von ECP auf die antivirale / antileukämische Funktion sind jedoch unklar und Gegenstand unserer Forschungsaktivitäten. Um den Wirk-mechanismus der ECP zu eruieren, haben wir eine umfassende Analyse von Effektor- und regulatorischen Zellen bei Patienten unter ECP-Therapie durchgeführt. Des Weiteren sind wir dabei, Prädiktoren für das klinische Ansprechen und somit für die Indikation zur ECP-Therapie zu definieren.
Forschungskooperationen
Universität Heidelberg:
- Nierenzentrum Heidelberg: Prof. Dr. Martin Zeier, Prof. Dr. Claudia Sommerer, Prof. Dr. Christian Morath, PD Dr. Matthias Schaier
- Immunologie: Prof. Dr. Terneß, Dr. Christian Klein
DKFZ/NCT:
- Onkologie: Prof. Dr. Dirk Jäger
- Translationale Immunologie: Prof. Dr. Rienk Offringa, Prof. Dr. Stefan Eichmüller
Universität Jena:
- Hämatologie/Stammzelltransplantation: PD Dr. Inken Hilgendorf
Universität Ulm:
- Hämatologie/Onkologie: Prof. Dr. Jochen Greiner
- Stammzelltransplantation: Prof. Dr. Donald Bunjes,
Universität Rostock:
- Mol. Onkologie: PD Dr. Michael Linnebacher
Med. Universität Lublin:
- Exp. Hämatologie: Prof. Dr. Krzysztof Giannopoulos
- Onkologie: Prof. Dr. Iwona Hus
Sheba Medical Center Tel-HaShomer/University Tel Aviv, Israel
- Stammzelltransplantation: Prof. Dr. Arnon Nagler, Dr. Ronit Yerushalmi, Dr. Jonathan Canaani
Mie University Graduate School of Medicine:
- Gentherapie/Immuntherapie/GMP Facility: Prof. Dr. Hiroshi Shiku
Nagasaki University Graduate School of Medicine:
- Exp. Onkologie, Prof. Dr. Hiroaki Ikeda
Southeastern University Nanjing:
- Hämatologie/Stammzelltransplantation: Prof. Dr. Bao-an Chen