- Sektion Nephrogenetik (AG Simons)
- Seniorprofessur Prof. Rappold
- Molekulare Neurogenetik (AG Berkel)
- Kardiogenetik (AG Hoffmann)
- Genomisches Neugeborenenscreening
- Translationale Neurowissenschaften (AG Althammer)
- Neurogastrogenetik (AG Schmitteckert)
- Regulierung der Transkription bei Entwicklungsstörungen (AG Laugsch)
- Genetik neurologischer Entwicklungsstörungen (AG Schaaf)
- Mausmodelle für neurologische Entwicklungsstörungen (AG Fröhlich)
- Forschung der genetischen Poliklinik
- Forschung in der Diagnostik
- Publikationen
Kardiogenetik (AG Hoffmann)
Forschungsgruppe

Annette Löwen (MTA); Kristin Rädecke (PhD Studentin); Ambuj Gore (MSc Student); Sandra Hoffmann (Arbeitsgruppenleiterin) (von links nach rechts)
Forschungsschwerpunkt
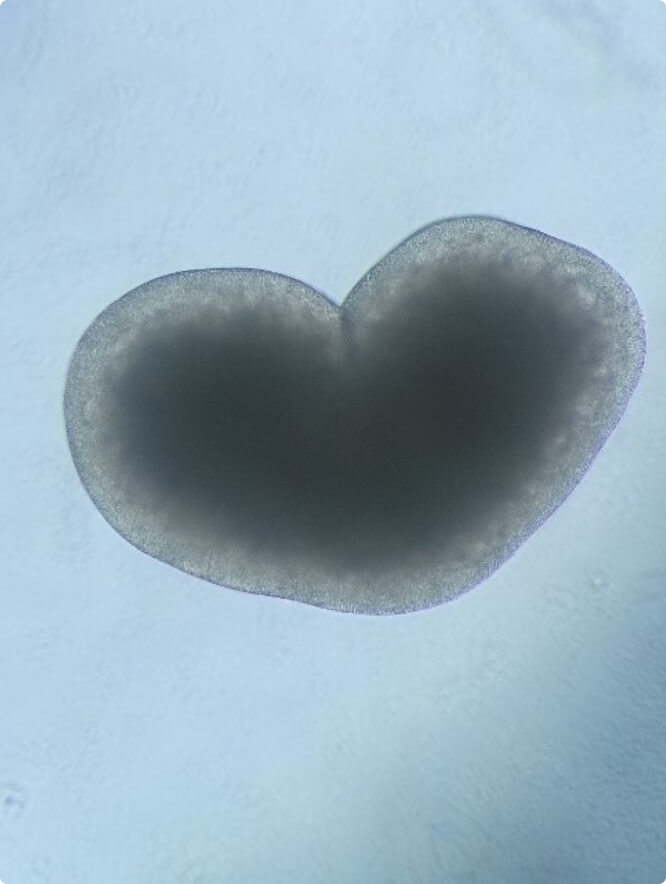
Der Herzrhythmus wird von einer Population spezialisierter Zellen im Sinusknoten, dem natürlichen Schrittmacher des Herzens, reguliert. Herzrhythmusstörungen sind pathologische Abweichungen vom normalen Herzschlag und gehören zu den häufigsten Herzerkrankungen.
In den letzten Jahren hat sich gezeigt, dass Transkriptionsfaktoren und ihre Zielgene eine wichtige Rolle in der Pathophysiologie von Vorhofflimmern, der häufigsten Herzrhythmusstörung, spielen. Dennoch ist unser Wissen über genregulatorische Netzwerke im Zusammenhang mit Vorhofflimmern nach wie vor begrenzt. Basierend auf unseren Analysen konnten wir einen funktionellen Zusammenhang zwischen der Expression des Homöodomänen-Transkriptionsfaktors SHOX2, der Entwicklung des Sinusknotens und arrhythmogenen Phänotypen wie Vorhofflimmern und Sinusknoten-Dysfunktion herstellen.
Genetische Veränderungen tragen erheblich zu einem erhöhten Risiko von Herzrhythmusstörungen bei. Mit Hilfe modernster Methoden möchten wir daher zugrunde liegende genetische Netzwerke und Prozesse aufklären. Hierfür nutzen wir verschiedene Modellsysteme und Technologien, darunter Tiermodelle (transgene Mäuse, Zebrafische), Patientenmaterial und pluripotente Stammzellen (patientenspezifische iPSCs, Maus ESCs), kombiniert mit zellulären und molekularbiologischen Methoden, Genom-Editierung (CRISPR-Cas9), sowie Genom-, Epigenom- und Transkriptom-weiten Analysen.
iPSC-basierte Modelle, welche potenziell krankheitsverursachende genetische Varianten tragen, sind äußerst wertvoll für die Aufklärung der zugrunde liegenden molekularen Mechanismen bei atrialen Herzrhythmusstörungen. Darüber hinaus bieten solche Forschungsansätze ein präklinisches Modell für die Identifizierung und Auswahl neuartiger therapeutischer Ziele und ebnen den Weg zur personalisierten Medizin.
Arbeitsgruppenleiterin

PD Dr. rer. nat. Sandra Hoffmann
Schwerpunkt
Arbeitsgruppe Kardiogenetik

Publikationen
Identification and Tissue-Specific Characterization of Novel SHOX-Regulated Genes in Zebrafish Highlights SOX Family Members Among Other Genes.
S. Hoffmann, R. Roeth, S. Diebold, J. Gogel, D. Hassel, S. Just, G. A. Rappold.
Front. Genet.. 2021 May 27;12. doi: 10.3389/fgene.2021.688808.
Network-driven discovery yields new insight into Shox2-dependent cardiac rhythm control.
S. Hoffmann, S. Schmitteckert, K. Raedecke, D. Rheinert, S. Diebold, R. Roeth, B. Weiss, M. Granzow, B. Niesler, A. Griesbeck, et al.
Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms. 2021 April;1864(4-5):194702. doi: 10.1016/j.bbagrm.2021.194702.
Precise Correction of Heterozygous SHOX2 Mutations in hiPSCs Derived from Patients with Atrial Fibrillation via Genome Editing and Sib Selection.
S. A. Sumer*, S. Hoffmann*, S. Laue, B. Campbell, K. Raedecke, V. Frajs, S. Clauss, S. Kääb, J. W. Janssen, A. Jauch, et al.
Stem Cell Reports. 2020 October;15(4):999-1013. doi: 10.1016/j.stemcr.2020.08.015.
Functional Characterization of Rare Variants in the SHOX2 Gene Identified in Sinus Node Dysfunction and Atrial Fibrillation.
S. Hoffmann, C. Paone, S. A. Sumer, S. Diebold, B. Weiss, R. Roeth, S. Clauss, I. Klier, S. Kääb, A. Schulz, et al.
Front. Genet.. 2019 Jul 11;10. doi: 10.3389/fgene.2019.00648.
Murine transgenic embryonic stem cell lines for the investigation of sinoatrial node-related molecular pathways.
S. Schmitteckert, A. Griesbeck, S. Sumer, A. Jauch, A. Rolletschek, B. Niesler, G. A. Rappold, S. Hoffmann.
Stem Cell Research. 2017 December;25:278-282. doi: 10.1016/j.scr.2017.07.011.
Comparative expression analysis of Shox2 -deficient embryonic stem cell-derived sinoatrial node-like cells.
S. Hoffmann*, S. Schmitteckert*, A. Griesbeck, H. Preiss, S. Sumer, A. Rolletschek, M. Granzow, V. Eckstein, B. Niesler, G. A. Rappold.
Stem Cell Research. 2017 May;21:51-57. doi: 10.1016/j.scr.2017.03.018.
Coding and non-coding variants in the SHOX2 gene in patients with early-onset atrial fibrillation.
S. Hoffmann, S. Clauss, I. M. Berger, B. Weiß, A. Montalbano, R. Röth, M. Bucher, I. Klier, R. Wakili, H. Seitz, et al.
Basic Res Cardiol. 2016 Apr 30;111(3). doi: 10.1007/s00395-016-0557-2.
Islet1 is a direct transcriptional target of the homeodomain transcription factor Shox2 and rescues the Shox2-mediated bradycardia.
S. Hoffmann, I. M. Berger, A. Glaser, C. Bacon, L. Li, N. Gretz, H. Steinbeisser, W. Rottbauer, S. Just, G. Rappold.
Basic Res Cardiol. 2013 March;108(2). doi: 10.1007/s00395-013-0339-z.
Shox2 mediates Tbx5 activity by regulating Bmp4 in the pacemaker region of the developing heart.
S. Puskaric (= S. Hoffmann), S. Schmitteckert, A. D. Mori, A. Glaser, K. U. Schneider, B. G. Bruneau, R. J. Blaschke, H. Steinbeisser, G. Rappold.
Human Molecular Genetics. 2010 Sep 21;19(23):4625-4633. doi: 10.1093/hmg/ddq393.
(* shared authorship)
- Sektion Nephrogenetik (AG Simons)
- Seniorprofessur Prof. Rappold
- Molekulare Neurogenetik (AG Berkel)
- Kardiogenetik (AG Hoffmann)
- Genomisches Neugeborenenscreening
- Translationale Neurowissenschaften (AG Althammer)
- Neurogastrogenetik (AG Schmitteckert)
- Regulierung der Transkription bei Entwicklungsstörungen (AG Laugsch)
- Genetik neurologischer Entwicklungsstörungen (AG Schaaf)
- Mausmodelle für neurologische Entwicklungsstörungen (AG Fröhlich)
- Forschung der genetischen Poliklinik
- Forschung in der Diagnostik
- Publikationen




